
题目列表(包括答案和解析)
(三)实验用品及试剂:
(1)仪器和用品:(自选,略)
(2)试剂:指示剂 (填名称)、浓度为7.5×10-3mol/L标准碘溶液、蒸馏水等 。
(二)测定原理:C6H8O6+I2 C6H6O6+2H++2I-。
C6H6O6+2H++2I-。
(一)测定目的:测定××牌软包装橙汁维生素C含量。
1.下图为用氢气还原氧化铜的微型快速实验装置。
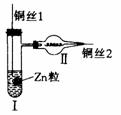
实验前先将铜丝1处理成下端变曲的一小圆环,并用铁锤击成带小孔的小匙;将铜丝2一端弯 曲成螺旋状(见图)。试回答下列问题:
(1)在具支试管Ⅰ中先加入的试剂是 。
(2)操作铜丝2的方法是 。
(3)实验现象:Ⅰ中 ;Ⅱ中 。
(4)这样处理铜丝1的优点是 。这样处理铜丝2的目的是 。
(5)某学生把图A改成图B,容器内加有某液体X,稍加热,铜丝的操作方法同铜丝2。若发现铜丝由黑变红,则液体可能是 。
2.维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6。人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中维生素C的含量在500mg/L左右 。
校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量。下面是测定实验分析报告。(请填写有关空白)
7.金刚石是典型的原子晶体,晶体中的基本结构微粒是碳原子。每个碳原子和周围四个碳原子形成完全相同的共价单键,构成正四面体。
①在金刚石中的碳原子所构成的正四面体中,键角的余弦值是 (填数值)。
②金刚石中的碳原子位于正四面体的中心,周围四个碳原子位于四个顶点上,在空间构成连 续的、坚固的骨架结构。因此,可以把一块完美的金刚石晶体看成一个巨大的分子。若有一颗质量为0.2克拉的完美金刚石,可以认为它的“分子量”是(阿伏加德罗常 数取6.0×1023mol-1) 。
③高分子的分子量都在五千以上。上述这颗金刚石是否属于高分子化合物?
答: (填 “是”或“不是”)。因为 。
6.人体的血液中存在一定浓度的H2CO3、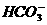 ,建立如下平衡:
,建立如下平衡:
H2CO3
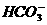 +H+
体内H2CO3浓度增大时,可分解,通过肺部排出CO2 。而
+H+
体内H2CO3浓度增大时,可分解,通过肺部排出CO2 。而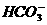 浓度太大时,可从肾脏增加排出量。血液中一定浓度的H2CO3、
浓度太大时,可从肾脏增加排出量。血液中一定浓度的H2CO3、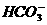 的存在,能帮助人体血液维持一定的pH值(7.35-7.45)。
的存在,能帮助人体血液维持一定的pH值(7.35-7.45)。
(1)人体血液的pH值变化0.4个单位以上,就会有生命危险。某病人血液的pH值较正常人(pH 以7.4计)变化了0.3个单位,他体内血液的H+浓度是正常人的 或 倍。(已知:lg2=0.3,lg3=0.48)
(2)当某些因素引起血液中酸度增加时,血液的pH值为什么能维持基本不变?用简要文字说明。
5.反应mA(g)+nB(g)  pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
|
压强/Pa |
2×105 |
5×105 |
1×106 |
|
c(A)mol/L |
0.08 |
0.20 |
0.44 |
分析表中数据,回答:
(1)当压强从2×102Pa增加到5×105Pa时,平衡 移动,(填“ 向 左”、“向右”或“不”)理由是 。
(2)当压强从5×105Pa增加到1×106Pa时,该反应的化学平衡 移动,判断的依的依据是 ,可能的原因是① ,② 。
4.某科研小组用高岭土(主要成分是Al2(Si2O5)(OH)4,并含有少量CuO、Fe2O 3)研制新型净水剂,其实验步骤如下:将土样和纯碱混合均匀加热熔融,冷却后用水浸 取熔块,过滤,弃去残渣,滤液用盐酸酸化,经过滤分别得沉淀和溶液,溶液即为净水剂。 试回答下列问题:
(1)用氧化物表示高岭土的主要成分: 。
(2)写出熔融时主要成分(即各氧化物)分别与纯碱反应的化学方程式: 。
(3)最后得到的沉淀是 ,生成沉淀的离子方程式是 。
(4)本实验在熔融土样时应选用的坩埚是 (填“瓷坩埚”、“氧化铝坩埚”、“铁坩 埚”)。
3.苏打和小苏打有着广泛的应用。试从消耗反应物的量的角度,回答下列问题:
(1)做面条时防止面粉较长时间储存变酸味,常加入适量的面碱,选用 ,因为
。
(2)作为泡沫灭火器的药品,选用 ,因为 。
(3)用于洗涤餐具及实验室的玻璃仪器等,选用 ,因为 。
2.炭火炉燃烧炽热时,在往炉膛底的热灰上喷洒少量水的瞬间,炉子的火更旺,这是因为
。如果烧去同量的碳,喷洒过水的和没有喷洒过水的炭火炉放出的总热量
(填“相同”或“不同”),因为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com