
题目列表(包括答案和解析)
21.(4分)用化学用语回答下列问题。
⑴画出S2-的离子结构示意图:_ _。
⑵画出NaOH的电子式:_ _。
⑶写出双氧水中加少量MnO2的化学反应方程式:_ _。
24(8分) 0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72L氢气。等量的R元素的单质与足量的氧气化合,可生成10.2gR元素的最高价氧化物,R元素中子比质子多一个。求R的相对原子质量及在元素周期表中的位置。
25(8分)在铜片中加入某浓度的硫酸35.3mL,在加热条件下反应,待铜片全部溶解后,测得所生成的SO2在标况下的体积为5.6L。将所得的溶液稀释到150mL,再加入足量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后质量为93.2g。求原硫酸的物质的量浓度?
23.(4分)选用合适的试剂除杂括号内的为杂质
CO2( (SO2) __________________ SO2(HCl )___________________
H2S(HCl)___________________ Cl2(HCl)___________________
22.(12分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL 18mol·L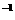 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。①请写出铜跟浓硫酸反应的化学方程式:
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。①请写出铜跟浓硫酸反应的化学方程式:
___________________ __ 。
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:
__________________________________________________________________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_____(填写字母编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是_______(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量酸性KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
②乙学生设计的方案操作更简单,但能同样达到目的。请你帮助乙同学设计一个实验方案。
____________________________________________________________
21.(8分)A、B是两种有刺激性气味的气体,试根据以下物质之间的反应关系推断:
(1)A→G各是什么物质,其化学式分别是:A________,B________,C____,D________,E_________F______.G________。
(2)写出A、B与水三者反应的离子方程式:______________________________________。
19(8分)在原子序数为 1 - 18 号的元素中, 用适当的化学符号填写下列空白(稀有气体除外):
(1)原子半径最大的是 _______ , 简单离子中, 离子半径最大的是 _____ 。
(2)气态氢化物最稳定的是 ___ , 气态氢化物中含有H 元素质量分数最大的氢化物是___。
(3)酸性最强的无氧酸是______,酸性最强的含氧酸是 _________,碱性最强的是_______,属于两性氢氧化物的物质是___________.
20.(8分)短周期四种元素A、B、C、D原子序数依次增大,A元素原子最外层电子数为次外层电子数的2倍,C元素原子的次外层电子数为最外层电子数的2倍,C与D可形成共价化合物CD4,B与D可形成离子化合物BD2。
(1)用电子式表示BD2的形成过程: .其中离子半径的大小关系:B D(填“>”或“<”=
(2)A、C、D三种元素所对应的气态氢化物中,最不稳定的是 (填电子式),最高价氧化物的水化物酸性最强的是 (填分子式)。
18.几种短周期元素的原子半径及主要化合价见下表: ( )
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
下列叙述不正确的是 ( )
A.L,R的单质与盐酸反应的剧烈程度:前者强于后者
B.Q,T两元素形成的化合物有两种
C.L,Q形成的简单离子核外电子数相等
D.M,T形成的化合物既可以与酸反应又可以与碱反应
 安徽省潜山中学2005-2006学年度第二学期期中考试
安徽省潜山中学2005-2006学年度第二学期期中考试
高 一 化 学 试 题
请将选择题答案填入下表:
17.下列说法正确的是:(NA表示阿伏加德罗常数的数值) ( )
A.20gH218O和34g H2O2中均含有2NA对共用电子对
B.1molNa2O2与1molNa2O所含阴离子数分别是:2NA个和NA个
C.常温常压下,3.5g35Cl2所含原子数为0.1NA
D.常温常压下,22.4LO3气体含有3NA个原子
16.在短周期元素中,两种元素X、Y可形成多种XY3型化合物。下列说法错误的是( )
A.化合物XY3溶于水形成的溶液可能显酸性也可能显碱性
B.X和Y可能属于同一周期,也可能属于不同周期
C.X的化合价可能显正价也可能显负价
D.X和Y一定属于同一主族
15.下列化合物不能由相应的元素的单质直接化合得来的是 ( )
① CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2 ⑦H2Te ⑧H2S
A.②⑤⑧ B.①④⑥ C.③④⑦ D.①④⑥⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com