
题目列表(包括答案和解析)
3.下列各组物质,能互称为同系物的一组是
A.O2和O3
B.H2C=CH2和CH3CH2CH=CH2
C.CH3CH2CH=CH2和CH3CH=CHCH3
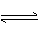 D.丁烷和异丁烷
D.丁烷和异丁烷
2.下列粒子中,中子数相同的是
A.40K和40Ca B.35Cl和35Cl–
C.14C和14N D.234U、235U和238U
1.下列说法正确的是
A.现在的《元素周期表》是俄国化学家门捷列夫1869年绘制的版本
B.糖类、油脂和蛋白质都是只含有C、H、O三种元素的有机物
C.已知1 molZn与1 mol H2SO4的能量大于1 mol ZnSO4与1 mol H2的能量,但是Zn与稀硫酸的反应不一定放出热量
D.凡是含有碳的化合物一定是有机物
28.(5分)某元素的同位素AZX,它的氯化物XCl2 3.33g溶于水制成溶液后, 加入1mol/L的AgNO3溶液60mL恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;
(3)把X的单质放入酚酞水溶液中,有何现象?写出反应的化学方程式.
27.(5分)向200mL1.0mol/LNaOH溶液中,通入3360mLSO2气体(气体体积是在标况下测定的),若SO2被完全吸收,溶液的体积变化可以忽略,
(1)反应后溶液中含有的溶质主要是______________________
(2)试计算反应后溶质的物质的量浓度.
26.(11分,每空1分)
下图是实验室制取SO2并验证SO2某些性质的装置图,试回答:
 ⑴①中发生反应的化学方程式为;_______________
⑴①中发生反应的化学方程式为;_______________
⑵②中的实验现象为_________,此实验证明SO2是_______ __氧化物;
⑶③中的品红溶液___________,此实验证明SO2有_________ ____性;
⑷④中的现象是_____________,此实验证明SO2有_________ __性;
⑸⑤中的现象是_____________,此实验证明SO2有___________ _ _性;
⑹⑥的作用是_______________,反应式是____________ ____ __
25.(6分)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38,Y元素原子最外层电子数占核外电子总数的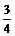 ;W元素原子最外层电子比同周期Z元素多5个电子,W和Y不属于同一主族。
;W元素原子最外层电子比同周期Z元素多5个电子,W和Y不属于同一主族。
(1)写出元素符号:X ,Y ,Z ,W ;
(2)Z、W两种元素最高价氧化物对应水化物反应的方程式是
24. ( 3分) 已知SO2遇H2S气体时表现出氧化性,发生如下反应:SO2+2H2S=3S+2H2O,在标准状况下,向一个容积为1L的容器里加入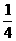 L的SO2和
L的SO2和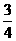 L的H2S,则反应结束时容器中的压强是开始的 倍。(水蒸气压忽略不计)
L的H2S,则反应结束时容器中的压强是开始的 倍。(水蒸气压忽略不计)
23. .(4分)氢化锂是一种离子化合物,LiH与H2O反应放出H2。写出该反应的
化学方程式: ,
反应后所得溶液呈 性(用“酸”或“中”或“碱”填)。
微粒半径: H- Li+(用“<”或“=”或“>”填)。
22. ( 2分)离子键强弱主要决定于离子半径和离子电荷数,一般规律是离子半径越小、离子的电荷数越大,则离子键越强。试分析①Na2O ②K2O ③MgO三种物质离子键由强到弱的顺序是(填序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com