
题目列表(包括答案和解析)
2.下列物质中,属于强电解质的是
A.Fe B. CO2 C. CH3COOH D. H2SO4
1.下列选项与氯气的用途无关的是
A.消毒灭菌 B.制漂白粉 C.从海水中提取食盐 D.制盐酸
25.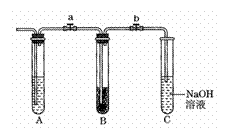 (12分)为探究过氧化钠与二氧化碳反应时是否在水蒸气存在下才能进行,某课外小组设计了如图所示的仪器装置:该小组要做两次实验,一是干燥的CO2与过氧化钠相接触,看结果是否发生反应。实验时在干燥的试管B中加入过氧化钠颗粒,并关闭止水夹a和b。在试管A中加入液体X后,通CO2并打开a和b,不久用余烬木条在C内试之,复燃。另一实验其他同前,只是在试管A中放入液体Y,结果末端未发生余烬木条复燃现象。经查阅资料,证明实验结果是正确的“干燥的二氧化碳不与过氧化钠反应”。
(12分)为探究过氧化钠与二氧化碳反应时是否在水蒸气存在下才能进行,某课外小组设计了如图所示的仪器装置:该小组要做两次实验,一是干燥的CO2与过氧化钠相接触,看结果是否发生反应。实验时在干燥的试管B中加入过氧化钠颗粒,并关闭止水夹a和b。在试管A中加入液体X后,通CO2并打开a和b,不久用余烬木条在C内试之,复燃。另一实验其他同前,只是在试管A中放入液体Y,结果末端未发生余烬木条复燃现象。经查阅资料,证明实验结果是正确的“干燥的二氧化碳不与过氧化钠反应”。
(1)加入的液体X是 ,Y是 。
(2)在通入CO2之前,应事先关闭a、b的目的是 。
(3)说明过氧化钠不与干燥的CO2反应,在B中的现象是 ,说明过氧化钠与湿润的CO2反应,在B中的现象是 。
(4)写出过氧化钠与湿润的CO2反应的化学方程式:
。
(5)试管C中NaOH溶液的作用是 ,反应的离子方程式是 。
24.(8分))根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度不得高于35℃,是因为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
23.(12分)正常情况下,大气中含有约78%的N2,21%的O2,还含有少量的CO2,水蒸气以及稀有气体和杂质。如果大气中二氧化碳的含量明显增加,就会引起“温室效应”,导致全球变暖。请完成下面各题:
(1)大气中二氧化碳主要来源于 。
(2)实验室中检验CO2气体最方便的方法是将CO2气体通入澄清石灰水中,产生的实验现象是 ,相应的离子方程式为 。
(3)在宇宙飞船的工作舱内装有过氧化钠,它的作用是再生氧气,如用超氧化钾(KO2)代替Na2O2也能起到到同样的作用(KO2与CO2反应也生成碳酸盐和氧气),你认为选用
作补氧剂更合适,理由是
。
(4)发射“神舟”飞船的火箭推进器中装有肼(N2H4)和H2O2,当它们混合时即产生水蒸气和空气中含量最多的气体并放出大量的热,该反应的化学方程式:
,该反应用于火箭推进器,除释放出大量热和快速产生大量气体外,还有一个很突出的特点是 。
22.(10分)Na2CO3、NaHCO3、NaCl的固体混合物共4.00 g,把它们加热到质量不再减轻,冷却后称得其质量为3.38 g。在残留固体中加入过量的盐酸,产生CO2 0.88 g。
(1)固体质量减轻了 g,这是因为发生了 反应(写化学方程式),从化学方程式可计算出原混合物中NaHCO3的质量 g,加热后新增加了Na2CO3 g。
(2)残余固体中加入过量盐酸的化学方程式 ,通过已知条件“产生的CO2 0.88 g”可以计算出参加反应的Na2CO3是 g,因为其中有 g Na2CO3是加热产生的,故原混合物中含Na2CO3 g。
(3)原混合物中含NaCl g。
21.(10分)有A、B、C、D、E五种物质在一定条件下的相互转化关系如图所示:已知常温条件下E为无色液体,D为无色气体,B为淡黄色固体。请回答下列问题:
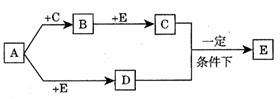
(1)A的化学式 ;E的化学式 。
(2)写出下列反应的化学方程式:
A与C作用得到B ;
B与E作用得到C ;
C与D作用得到E 。
(3)写出A与E作用的离子方程式 。
20.(6分)苏打和小苏打有着广泛的应用。试从消耗反应物的量等角度,回答下列问题:
(1)做面条时防止面粉较长时间储存变酸味,常加入适量的碱面,选用 ,因为 。
(2)作为泡沫灭火器的药品,选用 ,因为
。
(3)胃溃疡(胃壁溃烂或穿孔)病人的胃酸过多,医生给服用Al(OH)3胶乳,既不用苏打也不用小苏打是因为 。
19.(8分)根据下列反应回答有关问题:
3Cu + 8HNO3  3Cu(NO3)2
+ 2NO↑ + 4H2O
3Cu(NO3)2
+ 2NO↑ + 4H2O
(1)该反应中氧化剂是 ,被氧化的元素是 。
(2)硝酸表现的性质是 ,当有12.6 g HNO3被还原,生成气体的质量是 g。
(3)用双线桥法标出上述反应的电子转移情况
。
(4)将上述反应改写成离子方程式: 。
18.3.6 g CO和H2组成的混合气体与足量氧气充分燃烧后,立即将全部燃烧产物通过足量Na2O2固体,固体质量增加
A.2.1 g B.3.6 g C.7.2 g D.8.4 g
高 一 化 学(三)
班级 学号 姓名
第Ⅰ卷(选择题共54分)答案栏
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题共66分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com