
题目列表(包括答案和解析)
17.下列叙述正确的是( )
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
 C.在CaO和SiO2晶体中,都不存在单个小分子
C.在CaO和SiO2晶体中,都不存在单个小分子
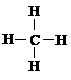
D. 甲烷的结构式: ,是对称的平面结构
16.以下说法正确的是 ( )
A.C60与金刚石一样属于原子晶体 B.干冰气化没有破坏化学键
C.共价化合物可以含离子键
D.水结成冰体积膨胀、密度变小,这一事实与水中存在氢键有关
15. 已知短周期元素的离子 aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是 ( )
A.原子半径 A>B>D>C B.原子序数 d>c>b>a
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
14.aXn-和bYm+两种离子,它们的电子层结构相同,下列关系式或化学式正确的是( )
A.a-n=b+m B. 氢化物HnX(或XHn) C.a+n=b-m D. 氧化物YOm
13. 1999年曾报导合成和分离了含高能量的正离子N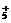 的化合物N5AsF6,下列叙述错误的是 ( )
的化合物N5AsF6,下列叙述错误的是 ( )
A.
N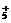 共有34个核外电子 B.N
共有34个核外电子 B.N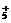 中氮-氮原子间以共用电子对结合
中氮-氮原子间以共用电子对结合
C.化合物N5AsF6中As的化合价为+1 D.化合物N5AsF6中F的化合价为-1
12.元素性质呈周期性变化的决定因素是 ( )
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
11.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为 ( )

10.下列说法正确的是 ( )
A.钠原子与氯气分子反应生成氯化钠后,其结构的稳定性增强
B.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小
C.失电子难的原子获得电子的能力一定强
D.两个原子之间的相互作用叫化学键
9.下列物质的电子式书写正确的是 ( )

8.在短周期元素中,原子最外电子层只有1个或2个电子的元素是 ( )
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com