
题目列表(包括答案和解析)
4.已知元素R的某种同位素的氯化物RClx为离子晶体,晶体中R微粒的核内中子数为Y,
核外电子数为Z,则该同位素的符号为
A.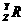 B.
B. C.
C. R D.
R D.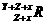
3.下列分子的电子式书写正确的是
A 氨  B 四氯化碳
B 四氯化碳 
C 氮 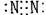 D 二氧化碳
D 二氧化碳 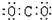
2.某元素最高价氧化物对应的水化物的分子式是H4RO4,则其气态氢化物的分子式是
A.RH4 B.RH3 C.H2R D.HR
1.在短周期元素中,原子最外电子层只有1个或2个电子的元素是
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
32.(7分)0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72L氢气。等量的R元素的单质与足量的氧气化合,可生成10.2gR元素的最高价氧化物,R元素中子比质子多一个。求R的相对原子质量及在元素周期表中的位置。
31.(5分)某Na2SO3试剂已部份被氧化为Na2SO4,为确定其纯度,进行如下实验:①称取样品A g; ②将样品溶解; ③向溶液中加入稍过量的盐酸酸化的BaCl2溶液; ④过滤、洗涤、干燥沉淀,称其质量为Bg。试回答:
(1)BaCl2溶液要用盐酸酸化且过量的原因是
。
(2)沉淀需洗涤的原因及判断沉淀已经洗净的方法分别是
(3)Na2SO3的纯度表达式Na2SO3%= 。(用含A、B的式子表示)
30.(提示:酸性高锰酸钾溶液可把SO2氧化成H2SO4),如图,回答下列问题
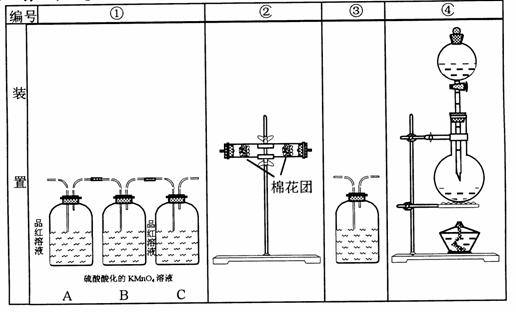 ⑴浓硫酸与木炭粉在加热条件下反应的化学方程式是
⑴浓硫酸与木炭粉在加热条件下反应的化学方程式是
____ ________;
⑵试用上图所示各装置设计一个实验,来验证上述反应所产生的各种产物,这些装置的连接顺序(气流从左至右的方向)是(填装置的编号):
____→____→____→______。
⑶实验时可观察到装置①中A瓶溶液__________,C瓶溶液__________,
B瓶溶液的作用是______ ____。
⑷装置②中所加的固体药品是_____________,可验证的产物是 ________。
⑸装置③发生反应的离子方程式是________________。
29.(4分)在1H216O、D232S、3H218O、32S17O2、2H232S、32S16O2中共有_______(填“字母”)
A.2种元素 B.3种元素 C.8种原子 D.7种原子
E.6种分子 F.5种分子
28.(14分)现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
⑴A、B、C、D、E各是什么元素(写元素名称):
A______、B_____、C_____、D_______、E________ 。
⑵A的原子结构示意图___________,B的离子结构示意图_________
D的单质分子的电子式________, C元素最高价氧化物的水化物的电子式_______
⑶写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
___________________________,___________________
⑷比较B、C、E三种元素形成的简单离子其离子半径的大小和氧化性的强弱:(B、C、E离子用实际离子符号表示)
离子半径:____ ___ __;氧化性:_________ _________。
(5)写出E与冷水反应的化学方程式:
___________________ ________。
27.(5分)氢化锂是一种离子化合物,LiH与H2O反应放出H2。
(1)写出反应的化学方程式: , 反应后所得溶液呈 性(用“酸”或“中”或“碱”填)。
(2)LiH的电子式 ,微粒半径:H-- Li+(用“<”或“=”或“>”填)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com