
题目列表(包括答案和解析)
(二)方法规律
1. 有关氧化还原反应的规律总结
(1)物质氧化性或还原性强弱
① 氧化还原反应发生的方向
氧化剂 + 还原剂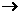 还原产物 + 氧化产物
还原产物 + 氧化产物
强氧化性 + 强还原性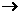 弱还原性 + 弱氧化性
弱还原性 + 弱氧化性
② 金属活动性顺序
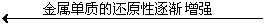
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au

③ 非金属活动性顺序
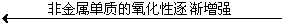
F Cl Br I

(2)氧化还原反应过程中的规律
① 反应顺序:
当一种氧化剂同时遇到了多种还原剂时,还原性最强的首先被氧化
② 电子守恒:
任何氧化还原反应中,氧化剂的得电子总数,一定等于还原剂的失电子总数。
③ “邻位不反应”规律
具有相邻价态的同种元素间不发生氧化还原反应。
④ “化合价不交叉”规律
具有不同价态的同种元素反应时,该元素的化合价不能交叉换位。
(一)知识归纳及基本概念
1. 化学反应的分类

2. 氧化还原反应中有关概念及其关系:
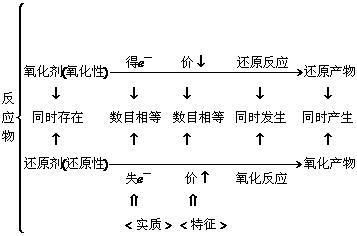 生成物
生成物
3. 电解质
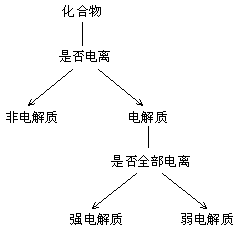
*注:物质电离是需要外界条件的
|
|
强电解质 |
弱电解质 |
|
|
相同点 |
都能在水溶液或熔化状态下产生离子 |
||
|
不 同 点 |
概念 |
全部电离 |
部分电离 |
|
表示 |
不可逆过程,“ ” ” |
可逆过程“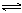 ” ” |
|
|
粒子的 |
只存在电离生成的 |
存在大量的电解质分子 |
|
|
存在形式 |
阴、阳离子,不存在分子 |
少量存在电离产生的阴、阳离子 |
*注:相关知识包括
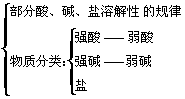
4. 离子反应

5. 物质的量
4. 阿伏加德罗常数问题。溶质的质量分数、溶解度等有关溶液组成的计算。
3. 以“物质的量”为桥梁进行的有关物质的质量、气体体积、物质的微粒数、物质的量浓度之间的计算。
2. 电解质、非电解质、强电解质、弱电解质、离子反应、离子方程式等重要的基本概念;电离的规律,离子反应的类型,离子方程式的书写等规律的综合应用。
1. 氧化还原反应、氧化剂、还原剂、氧化产物、还原产物等重要的基本概念;氧化还原反应中的重要规律以及上述概念、规律的综合应用。
22.有一块表面氧化成氧化钠的金属钠,总质量为5.22g,投入到94.98g水中,待充分反应后收集到氢气0.2g求
(1)其中含氧化钠的质量是多少g?
(2)反应后所得氢氧化钠溶液的质量分数是多少?
21.相同质量的钠、镁、铝与过量的稀硫酸反应,在状况下产生氢气的质量比是 ,若过量的相同质量的钠、镁、铝与相同质量分数,相同质量的硫酸溶液反应,产生氢气最多的是 。
20.将小块金属钠投入氯化铁溶液中观察到的现象是 ,其离子方程式为 ,其中氧化剂是 。
19.金属钠在700℃ -800℃时与四氯化钛(TiCl4)反应制取金属钛,该反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com