
题目列表(包括答案和解析)
6. 某实验需要 固体,用托盘天平称取固体时,天平读数(游码及砝码)将( )
固体,用托盘天平称取固体时,天平读数(游码及砝码)将( )
A. 等于8.0g B. 等于8.00g C. 大于8.0g D. 等于0.2g
5. 有一支 酸式滴定管,其中盛有溶液,液面恰好在
酸式滴定管,其中盛有溶液,液面恰好在 刻度处。把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积( )。(东华杯竞赛题)
刻度处。把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积( )。(东华杯竞赛题)
A. 大于 B. 为
B. 为 C. 小于
C. 小于 D. 为
D. 为
4. 下列各组离子在水溶液中能大量共存的是( )。(山西省测试题)
A. 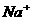 、
、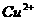 、
、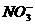 、
、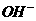 B.
B.
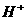 、
、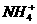 、
、 、
、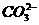
C. 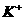 、
、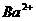 、
、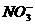 、
、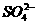 D.
D.
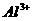 、
、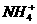 、
、 、
、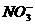
3. 已知:
(1)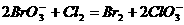 ;
;
(2)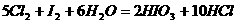
(3)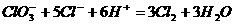
判断下列物质氧化能力强弱顺序正确的是( )。(杭州市质检题)
A. 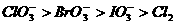 B.
B.
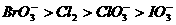
C. 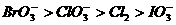 D.
D.
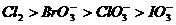
2. 在下列物质中,只有在溶液状态中才能导电的电解质是( )
A. 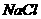 B.
B. 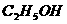 C.
C.  D.
D. 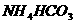
1. 强电解质和弱电解质的本质区别在于( )
A. 强电解质易溶于水,弱电解质难溶于水
B. 相同浓度时,溶液的导电能力的强弱
C. 在水溶液里电解质是否全部电离为离子
D. 是离子化合物还是共价化合物
(三)物质的量有关计算
1. 基本概念的计算
[例9] 设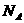 为阿伏加德罗常数,下列说法不正确的是( )
为阿伏加德罗常数,下列说法不正确的是( )
A. 常温常压下,11.2L氮气所含的原子数目为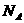 。
。
B. 活泼金属从盐酸中置换出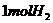 ,电子转移数为
,电子转移数为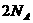 。
。
C. 

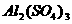 溶液中,
溶液中,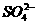 的浓度为
的浓度为 。
。
D. 在标准状况下,0.5NA个氧气分子所占的体积是11.2L。
分析:此题对物质的量的求算,从多方面进行考查,这里介绍一个涉及物质的量的“万能恒等式”,该恒等式在解答有关物质的量、物质的量浓度、摩尔质量、物质质量、气体体积、粒子数以及阿伏加德罗常数的问题可以有条不紊。为:

答案:A
2. 阿伏加德罗定律推论的考查
[例10] 氢气和氧气的混合气体,在120℃和一定压强下体积为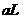 ,点燃后发生反应,待恢复至原来温度和压强时,测得其体积为
,点燃后发生反应,待恢复至原来温度和压强时,测得其体积为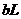 。原混合气体中氢气和氧气的体积各是多少升?
。原混合气体中氢气和氧气的体积各是多少升?
解析:这是根据阿伏加德罗定律进行讨论计算的能力考查题,比较快速的解法是“差量法”。
答案:
解:设参加反应的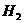 体积为
体积为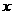 ,
,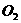 体积为
体积为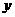
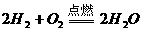 (气)
(气) 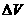
2 1 2 1
x y
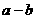
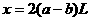
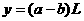
情况一:当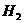 与
与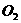 恰好完全反应时:
恰好完全反应时:
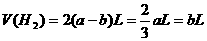
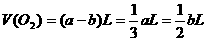
情况二:当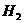 过量时,
过量时,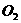 全部参加反应:
全部参加反应:
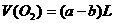
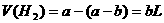
情况三:当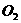 过量时,
过量时,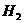 全部参加反应
全部参加反应
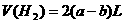
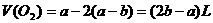
3. 关于天平平衡问题的讨论
[例11] 在托盘天平两盘上,各放有一杯等浓度、等质量的稀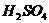 ,调节天平平衡后,往各杯内放入等质量的
,调节天平平衡后,往各杯内放入等质量的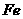 和
和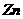 ,使其充分反应后,如果有如下情况时,天平是否保持平衡。
,使其充分反应后,如果有如下情况时,天平是否保持平衡。
(1)两边金属都完全反应而溶解,天平是否平衡?
(2)两边金属都有剩余,天平是否平衡?
(3)其中一杯中金属有剩余,则剩余的金属是什么?天平是否平衡?
分析:天平平衡问题的解题思路--抓本质,即烧杯内增重是否一样!酸和金属相对量可有下列三种情况:
(1)酸完全反应,放出气体相同。
A. 加入物,质量相等 天平仍平衡
天平仍平衡
B. 加入物,物质的量相等,质量不等 天平不平衡
天平不平衡
(2)酸过量,金属完全反应。
A. 加入物,质量相同,放出气体不同 天平不平衡。
天平不平衡。
B. 加入物,物质的量相同,质量不等,放出气体不一定相同,要考虑增重是否相等。(金属价态不同造成)
(3)加入的一种金属过量,另一种金属量不足。
A. 加入相同质量的两种物质,放出气体不同,天平不平衡。
B. 加入物质的量相同,要考虑增重是否相等。
答案:明确反应物与生成物的量的关系:
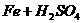 (稀)
(稀)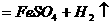
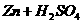 (稀)
(稀)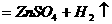
设每杯内各有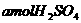 ,
,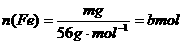
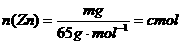 ,由方程式可知:
,由方程式可知:
(1)两种金属都溶解时,两边放出氢气分别为 和
和 ,因
,因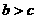 ,所以天平不平衡。
,所以天平不平衡。
(2)两种金属都剩余时,说明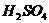 量不足,两边放出氢气都是
量不足,两边放出氢气都是 ,所以天平平衡。
,所以天平平衡。
(3)若一种金属有余,剩余的一定是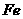 ,因为
,因为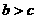 ,这里有两种情况:
,这里有两种情况:
①
当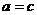 时,即
时,即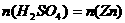 ,
,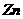 刚好溶解完,Fe剩余,两边放出H2都是
刚好溶解完,Fe剩余,两边放出H2都是 ,天平平衡。
,天平平衡。
②
当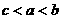 时,即
时,即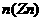
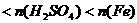 ,则Zn全溶解,Fe有剩余,两边放出H2分别为
,则Zn全溶解,Fe有剩余,两边放出H2分别为 和
和 ,则天平不平衡。
,则天平不平衡。
[模拟试题]
(二)离子反应:
1. 概念辨析的考查
[例5] 有下列物质① 石墨;②
铜丝;③ 氧气;④ 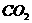 ;⑤ 食盐;⑥ 稀
;⑤ 食盐;⑥ 稀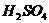 ;⑦ 水;⑧
;⑦ 水;⑧ 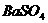 ;⑨ 金刚石,以下叙述正确的是( )
;⑨ 金刚石,以下叙述正确的是( )
A. 能导电的有①②⑤⑦ B. 属于电解质的有⑤⑥⑦⑧
C. 属于强电解质的有⑤⑧ D. ①②③⑨既不是电解质又不属于非电解质
分析:A. 弄清能导电与能电离的关系;B. 电解质务必属于化合物(纯净物);C. 分清能溶与能电离的差异;D. 非电解质也必须是化合物。
答案:C、D
2. 离子方程式书写的考查
[例6] 判断下列离子方程式书写是否正确,如不正确请更正:
(1)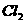 与
与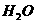 反应:
反应: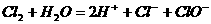
(2)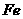 与稀
与稀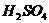 反应:
反应: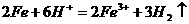
(3)实验室用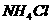 和
和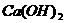 制
制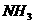 :
: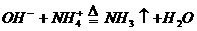
(4)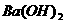 溶液与稀
溶液与稀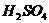 反应:
反应: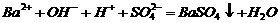
(5)过量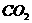 ,通入少量
,通入少量 溶液中:
溶液中: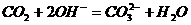
(6)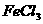 溶液与
溶液与 反应:
反应: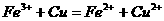
分析:
(1)拆分错误: 为弱电解质。
为弱电解质。
(2)原理错误:生成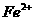
(3)不能书写离子方程式
(4)比例错误: 应带有
应带有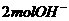 、
、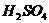 也是
也是
(5)量的错误:少量 与过量
与过量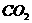 反应生成
反应生成
(6)电荷不守恒:反应前3+,反应后4+
答案:
(1)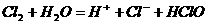
(2)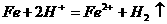
(3)无法书写
(4)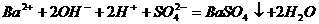
(5)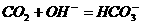
(6)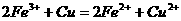
3. 电荷守恒的考查
[例7] 在一定条件下,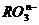 和
和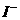 发生反应的离子方程式如下:
发生反应的离子方程式如下: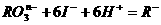
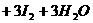 。
。
(1)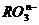 中R元素的化合价是
。
中R元素的化合价是
。
(2)R元素的原子最外层的电子数是 。
分析:
(1)离子方程式“ ”号两边电荷总数应相等,由此,可知
”号两边电荷总数应相等,由此,可知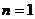 ,则
,则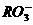 中R应为+5价。
中R应为+5价。
(2)题中由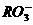 可知R为+5价,又由
可知R为+5价,又由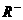 可知R为
可知R为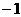 价,需要同学们对于非金属元素正、负价的成因有一定的了解,去除干扰项+5价,可知R最外层的电子数为7。
价,需要同学们对于非金属元素正、负价的成因有一定的了解,去除干扰项+5价,可知R最外层的电子数为7。
答案:(1)+5 (2)7
4. 离子共存的考查
[例8] 在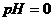 和
和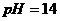 的无色透明溶液中,都能大量共存的离子组是( )
的无色透明溶液中,都能大量共存的离子组是( )
A. 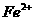 、
、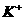 、
、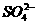 、
、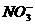 B.
B.
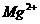 、
、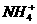 、
、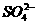 、
、
C. 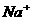 、
、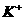 、
、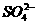 、
、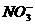 D.
D.
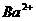 、
、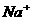 、
、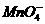 、
、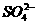
分析:认真审题,提炼条件: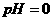 (酸性)、
(酸性)、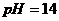 (碱性)、无色、共存。
(碱性)、无色、共存。
A. 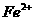 与
与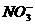 、
、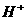 发生氧化还原反应
发生氧化还原反应
B. 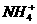 与
与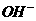 生成
生成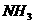
D. 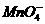 紫色,
紫色,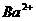 与
与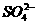 生成
生成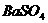 沉淀
沉淀
答案:C
(一)氧化还原反应
1. 基本概念的考查
[例1] 按要求完成下列反应方程式,用线桥标出反应的电子转移情况,注明氧化剂和还原剂。
(1)水既作氧化剂,又作还原剂 ;
(2)硫酸做氧化剂 ;
(3)氧气氧化某种非金属单质 ;
(4)非金属氧化物作还原剂 。
解析:紧扣概念:氧化剂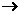 得
得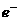
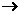 价
价 、还原剂
、还原剂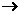 失
失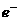
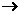 价
价 ;熟悉反应原理,对号入座。
;熟悉反应原理,对号入座。
答案: 氧化剂 还原剂
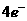
(1)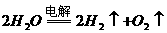
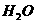
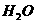

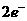
(2)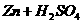 (稀)
(稀)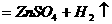
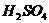
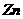
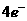
(3)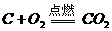
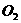
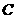
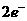

(4)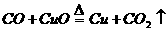
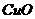

2. 反应规律的考查
[例2] 在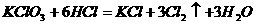 的反应中,当有
的反应中,当有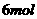 电子发生转移,被氧化的氯原子与被还原的氯原子的原子个数比为( )
A.
电子发生转移,被氧化的氯原子与被还原的氯原子的原子个数比为( )
A. 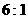 B.
B. 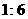 C.
C. 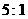 D.
D. 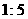
分析:此题关键是弄清氧化剂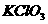 中+5价的氯在还原产物中的价态,有下面两种结果
中+5价的氯在还原产物中的价态,有下面两种结果
得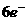

 (1)
(1)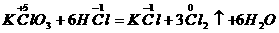 错
错
失
得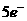

 (2)
(2)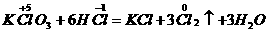 对
对
失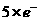
(1)错在违背了化合价不交叉的规律,在分析清楚被氧化与被还原的氯原子后,即可得出正确答案。
答案:C
3. 氧化性(还原性)强弱的比较
[例3] 常温下,可以发生下列三个反应:
(1)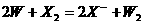
(2)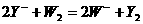
(3)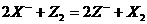
由此得出的正确结论是( )
A. 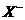 、
、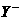 、
、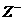 、
、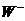 中
中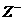 还原性最强
还原性最强
B. 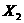 、
、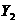 、
、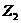 、
、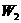 中
中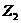 氧化性最弱
氧化性最弱
C. 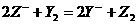 不能向右进行
不能向右进行
D. 还原性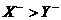
解析:氧化还原反应发生的方向为:强氧化剂+强还原剂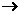 弱氧化剂+弱还原剂。
弱氧化剂+弱还原剂。
答案:C
4. 典型计算
[例4] 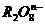 离子在一定条件下可以把
离子在一定条件下可以把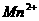 离子氧化为
离子氧化为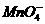 ,若反应后
,若反应后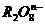 变为
变为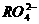 离子,且反应中氧化剂与还原剂的物质的量之比为
离子,且反应中氧化剂与还原剂的物质的量之比为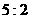 ,则
,则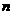 值( )
值( )
A. 4 B. 3 C. 2 D. 1
分析:氧化还原反应的计算多数不必书写完整的化学方程式,只要抓住“氧化剂得电子总数=还原剂失电子总数”这一守恒规律,即可判断有关元素的化合价。
答案: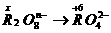 :得
:得
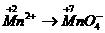 :失
:失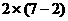
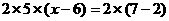
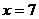 即
即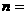 2
2
(三)有关离子反应规律的总结
1. 判断离子方程式书写是否正确的方法--六查
查反应本质、查物质拆分、查三个守恒(原子、电荷、电子)
查条件符号、查离子比例、查量的关系。
2. 离子间不能共存的原因:
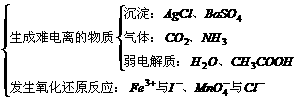
*注:
(1)关于离子间不能共存的规律,我们还将在今后的学习中进一步完善。
(2)已知条件中特别提到颜色时,决定了某些离子不能存在: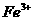 (黄)、
(黄)、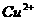 (黄)、
(黄)、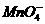 (紫)。
(紫)。
[典型类型题]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com