
题目列表(包括答案和解析)
22.4L·mol-1(x+y)==1.12L
71g·mol-1x+28g·mol-1y==3.34g
答:
乙:71g·mol-1x+28g·mol-1(1-x)== ×22.4L·mol-1
×22.4L·mol-1
答:
丙:(3-1):2== :x
:x
答:
丁:3:(x-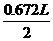 )==1:[
)==1:[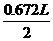 -(1.12L-x)]
-(1.12L-x)]
答:
(2)被氧化的m(NH3)= 。
 26R.(10分)离子晶体中的阴、阳离子是有规律排布的,从某离子晶体中可以取出如图所示的“结构单元”,X射线测得该“结构单元”中阳离子与阴离子离子间的距离为dcm。
26R.(10分)离子晶体中的阴、阳离子是有规律排布的,从某离子晶体中可以取出如图所示的“结构单元”,X射线测得该“结构单元”中阳离子与阴离子离子间的距离为dcm。
(1)在该离子晶体中,阳离子与阴离子的数目比为 ,平均 cm3的体积内含有1个阳离子。
(2)若该晶体的密度为p(g·cm-3),则其摩尔质量的表达式为:
M= g·mol-1。
25.(9分)将12.6克无水亚硫酸钠固体加入100mL8mol/L的硫酸中以制取SO2气体,反应完全后,若溶液中含+4价硫元素的物质的总浓度为0.2mol/L,假定溶液体积不变,忽略容器及导管中的气体体积,求:
(1)溶液中所有硫元素的质量。
(2)收集到SO2气体多少毫升(标准状况下)?
26H.(10分)将C12通入浓氨水中可发生下列反应:3C12+8NH3=6NH4Cl+N2,今使体积为1.12L,质量为3.34g的C12和N2的混合气体通过浓氨水,充分反应后,收集得0.672L[其中V(C12)=V(N2),以上气体体积均在标准状况测定]。
|
 (1)下面是几位同学从不同思路解此题的第一步算式。试分析其中未知数x的化学意义,并填入下列空格。
(1)下面是几位同学从不同思路解此题的第一步算式。试分析其中未知数x的化学意义,并填入下列空格。23.(8分)A、B、C、D四种短周期元素的核电荷数依次增大,A元素原子核外只有1个电子,B元素为短周期中金属性最强的元素,C元素原子最外层有6个电子,D元素的最高价氧化物对应水化物是最强的含氧酸。据此回答下列问题:
(1)B元素在周期表中的位置为 ,B、C两元素形成化合物的电子式为: ,D元素形成的简单离子的结构示意图为 。
(2)用电子式表示A、D两元素形成化合物的过程: 。
(3)检验C元素最高价氧化物对应水化物的水溶液中阴离子时的离子方程式为: 。
24H。(12分)下表是元素周期表的一部分,请用元素符号或相应物质的化学式回答下列有关问题:
|
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
③ |
④ |
⑤ |
⑥ |
|
⑦ |
⑧ |
⑨ |
|
4 |
⑩ |
|
|
|
|
|
|
|
(1)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
(3)在这些元素中,原子半径最小的是 ,原子半径最大的是 。
(4)在③与④中,化学性质较活泼的是 ,怎样用化学实验证明?
。
24R.(11分)下图是1-18号元素中的部分连号元素(a-k)所形成的单质的熔点变化情况。
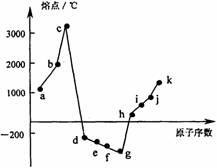
(1)a元素的原子核内有 个质子,与a元素处于同一主族的元素是 (选填图中字母代号);a元素的氢氧化物与j元素的氢氧化物性质相似,均能与h元素的氢氧化物发生反应,写出a元素的氢氧化物与h元素的氢氧化物发生反应的化学方程式: 。
(2)c元素有一种无色的单质晶体,熔点高达3550℃,其名称是 ,属于 晶体;c、d、e、f 4种元素所形成的氢化物中,沸点最低的氢化物是 (写分子式),沸点与其他氢化物相差较大的主要原因是 。
21.(6分)硒是一种保健元素,工业上从含硒的废料中提取硒的方法之一是用硫酸与硝酸处理废料,获得亚硝酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,化学反应方程式为:2HCl+H2SeO4=H2SeO3+Cl2↑+H2O。向亚硒酸溶液中通入SO2,即析出单质硒。
(1)比较:硒酸和硝酸的氧化性强弱 ;亚硒酸和盐酸的还原性强弱 。
(2)已知亚硒酸是弱酸,试写出向亚硒酸溶液中通入SO2的离子反应方程式: 。
22H.(12分)盐酸、硫酸和硝酸是中学阶段所常见的“三大酸”。现请就三大酸与金属铜反应情况,填空回答下列问题:
(1)我们知道,稀盐酸不与Cu反应。在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为 。
(2)在一定体积的18mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积 (填写“大于”、“等于”、或“小于”)lOOmL。
若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗? (填“同意”或“不同意”),原因是
。另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)
。
 22R.(12分)(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:
,该反应在 中进行。
22R.(12分)(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:
,该反应在 中进行。
(2)为了有利于SO2的转化为SO3,且能充分利用热能,采用了多层催化剂间有热交换器的接触室(见右图)。按此密闭体系中气体的流向,则C处流出的气体为 ,A、B、C三处气体的温度由高到低的顺序为 。
(3)在吸收塔中用 吸收SO3,从吸收塔上部导出的气体再次通入 ,进行第二次氧化,再进行一次吸收后将尾气中很少的SO2净化回收,以防污染大气。
20.(13分)应用下图所示的实验装置,可以设计一套用来检验硫酸和木炭反应的全部产物的装置。

(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
。
(2)仪器连接的顺序(由左向右连接,填装置编号)是 ,连接好的装置,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用来证明该装置不漏气简单的方法是 。
(3)装置C的作用是 ,该装置中的试剂还可以换成 。
(4)能确认混合气体中含有CO2和SO2的实验现象是
。
19.(8分)请你用实验室提供的下列试剂,设计两个原理不同的简单实验(只要写出实验方案),证明镁元素的金属性比铝强。
试剂:Mg条、Al丝、AlCl3溶液、MgCl2溶液、稀HCl、NaOH溶液
18.强氧化剂对引起“非典”的冠状病毒均有良好的杀灭作用。C12、C1O2(其还原产物为Cl-)、 O3(1molO3转化为1molO2和lmolH2O)、H2O2等物质都具有强氧化性,等物质的量的上述物质消毒效率最高的是
A.C12 B.ClO2 C.O3 D.H2O2
2002-2003学年度第二学期高一年级调研考试
化 学 试 题
第Ⅱ卷 (非选择题 共78分)
17.用98%浓H2SO4吸收SO3可以得到焦硫酸(H2SO4·SO3),若用1kg 98%H2SO4充分吸收SO3得到焦硫酸,再进行稀释,可得到98%的H2SO4的质量为
A.1.98kg B.2.00kg C. 2.22kg D.2.42kg
15.KMnO4溶液与H2O2在一定条件下发生反应的方程式如下:
2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O
下列对此反应的分析正确的是
A.反应中H2O2作还原剂,H2SO4作氧化剂 B.反应中H2O2既作氧化剂又作还原剂
C.反应中KMnO4作氧化剂,O2为还原产物D.反应中H2O2作还原剂,H2SO4起酸化作用
16H.一定条件下,RO3-与R-可发生反应RO3-+5 R-+6H+ = 3R2+3H2O,下列关于R元素的叙述中,正确的是
A.R2在常温常压下不一定是气体 B.R的气态氢化物的水溶液呈强酸性
C.RO3-中的R只能被还原 D.R位于周期表中VA族
16R.氧族元素的氢化物的沸点如下表:
|
H2O |
H2S |
H2Se |
H2Te |
|
100℃ |
-60.75℃ |
-41.5℃ |
-1.8℃ |
下列关于氧族元素氢化物沸点高低的分析和推断中,不正确的是
A.氧族元素氢化物的沸点高低与分子间作用力的大小无关
B.水分子中存在的化学键比其他氢化物分子中的化学键牢固
C.水分子之间一定存在其他氢化物分子间所没有的特殊的分子间作用力
D.H2S、H2Se、H2Te分子间作用力随相对分子质量的增大而增大
14.下列说法正确的是
A.经SO2漂白的草帽日久后会逐渐变成原来的黄色
B.足量的SO2通入紫色石蕊试液中可使石蕊变成无色
C.浓H2SO4有吸水性可用于干燥H2、CO2等气体
D.浓H2SO4滴在石蕊试纸上,石蕊试纸变成红色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com