
题目列表(包括答案和解析)
1.最近,兰州近代物理研究所研制出我国首批氧-18气体(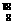 O2)。
O2)。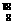 O称为重氧,下列说法中正确的是
O称为重氧,下列说法中正确的是
A 1.8g氧-18气体的物质的量是0.1 mol B 0.1mol重氧气体的体积是2.24L
C 重氧气体摩尔质量是36g D 0.1mol重氧水所含中子数约是6.02×1023
38.使一定质量的锌与100mL18.5mol/L浓H2SO4充分反应,锌完全溶解,同时生成气体A33.6L(标准状况下)。将反应后的溶液稀释至1L,测得溶液c(H+)为0.1mol/L,求气体A中各组分的体积比。
(提示:浓H2SO4与Zn反应时,随着反应的进行H2SO4由浓逐渐变稀、相应生成的气体也不同)
37.两份不同浓度的NaOH溶液各500mL,分别吸收1120mL,反应后溶液中分别有5.75g和7.1g溶质。求两份NaOH溶液的物质的量浓度。
(提示:SO2与NaOH反应时,当反应物间的物质的量比值不同,会有正盐或酸式盐生成)
36.我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:
|
测试时间/h |
0 |
1 |
2 |
3 |
4 |
|
雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析数据,回答以下问题:
①雨水样品的pH变化的原因(用化学方程式表示):
②如果将刚取样的上述雨水和自来水混和,pH将变 。(填“大”、“小”、“不变”)
(2)你认为减少酸雨产生的途径可采用的措施是 。
①少用煤作燃料 ②把工厂烟囱造高 ③燃烧脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①②⑤ D.①③④⑤
(3)在英国进行了一个研究,结果表明:高烟囱可以有效地降低其周围地表面SO2浓度。在20世纪的60-70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱,结果使附近地面SO2浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?简述其理由。
35.浓H2SO4和浓KClO3溶液反应,生成黄色气体ClO2(实验时小心将浓H2SO4逐滴滴入浓KClO3溶液中,且ClO2气体具有爆炸性),反应方程式如下:
KClO3+H2SO4(浓) 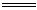 KHSO4+HClO3
KHSO4+HClO3
3HClO3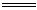 HClO4+H2O+2ClO2
HClO4+H2O+2ClO2
2ClO2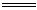 Cl2+2O2
Cl2+2O2
(1)设计一个实验,确定ClO2分解产物中O2与Cl2的体积比为2∶1(不需叙述HClO3的生成和分解的实验)。
(2)ClO2也能像Cl2一样,在强碱(如KOH)溶液中发生反应,其化学方程式是: 。(注意:反应产物除有水生成外,有氯化物和+5的氯的含氧酸盐)
34.矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。此处的风化作用是说矿物与H2O和CO2同时作用的过程。例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式是:
2KASi3O8+11H2O+2CO2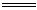 2K++2HCO3-+4H4SiO4+Al2Si2O5(OH)4这个反应能发生的原因是
。
2K++2HCO3-+4H4SiO4+Al2Si2O5(OH)4这个反应能发生的原因是
。
33.(1)短周期元素X、Y、Z在周期表中位置关系如下图所示。
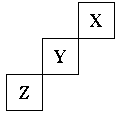
①X元素的单质分子式是 。
若X核内中子数与质子数相等,X单质的摩尔质量是 。
②Y单质的电子式是
Y单质与水反应的化学方程式:
Z与钙形成的化合物的电子式是:
(2)已知下列元素的原子半径:
|
元
素 |
N |
S |
O |
Si |
|
原子半径/10-10m |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷原子的半径(10-10m)可能的范围是 。(3)若X′、Y′是第1周期以外的短周期元素,它们可以形成化合物X′mY′n,且离子均具有稀有气体原子的电子层结构,则X′、Y′两原子的原子序数a、b的关系可表示为 、 、 。
32.在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出)。
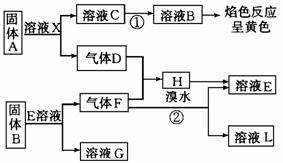
请回答:
(1)固体A是 (写化学式)
(2)反应①的化学方程式:
(3)反应②的化学方程式:
31.根据人们的实践经验,一般说来,极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂,根据这个实践经验,下列叙述不正确的是( )
A.氯化氢易溶于水,不易溶于苯(非极性分子)
B.碘易溶于CCl4(非极性分子),也易溶于水
C.食盐易溶于水,不易溶于汽油(非极性分子的混合物)
D.硫难溶于水,易溶于CS2液体中
30.A、B、C是周期表中相邻的三种元素,其中A、B同周期,B、C同主族。这三种元素在周期表中的位置可能有以下四种排列方式:
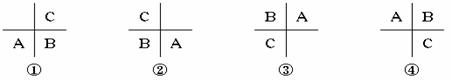
当此三种元素质子数总和为31,三种元素原子最外层电子数之和为17。则A、B、C应是( )
A.A、B在周期表中第4周期,C在周期表中ⅤA族
B.A、B在周期表中第3周期、,A在周期表中ⅥA族
C.A、B在周期表中第2周期,C在周期表中ⅥA族
D.A、B在周期表中第1周期,C在周期表中O族
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com