
题目列表(包括答案和解析)
5、A和B都是主族元素,A的原子序数为n,A2+比B2-少8个电子,则B的原子序数是( )
A.n+2 B.n+4 C.n+6 D.n+10
4、已知元素砷(As)的原子序数为33,下列叙述正确的是( )
A.砷元素的最高化合价为+3 B.砷元素是第四周期的主族元素
C.砷原子的第3电子层含有8个电子 D.砷的氧化物的水溶液呈强碱性
3、由两种互为同位素的中性原子分别组成X2和Y2两种分子,这两种分子不一样的是( )
A.电子总数 B.质子总数
C.相对分子质量 D.化学性质
2、在任何原子里都具有的粒子是( )
A.质子、中子、电子 B.质子、中子
C.质子、电子 D.中子、电子
1、以美国为首的北约部队在对南联盟的狂轰滥炸中使用了大量的贫铀弹。所谓“贫铀”是从金属铀中提取出 以后的副产品,其主要成分是具有低水平放射性的
以后的副产品,其主要成分是具有低水平放射性的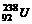 。下列有关
。下列有关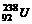 的说法中正确的是( )
的说法中正确的是( )
A.中子数为146 B.质子数为238
C.质量数为330 D.核外电子数为146
4、分子间力:能使分子间发生聚集或有序排列的电性作用,这种作用,此化学键弱。
通常分子间力越小,物质沸点越高。相对分子质量相近的分子,分子极性越强,分子间力越大;组成结构相似的分子,随相对分子质量增大,分子间力增强。
第五章 物质结构 元素周期律试题
相对原子质量:H-1,C-12,N-14,O-16
3、极性分子和非极性分子
(1)极性分子:以极性键形成,分子结构不能造成键的极性互相抵消,分子两端显现正负电性之差的分子,可形象表示为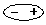 。
。
(2)非极性分子:不显现两端正、负性差的分子,可形象表示为 。例如:
。例如:
①He、Ne、Ar等稀有气体原子间无化学键存在的分子。
②H2、N2、Cl2等同种元素原子间以非极性键形成的单质分子。
③CO2、BF3、CH4等以极性键形成,分子结构对称,键的极性互相抵消的分子。
2、共价键(重点是表示方法)
原子间通过共用电子对形成的相互作用叫共价键。非金属元素原子间多以共价键结合。
同种元素原子间,共用电子对无偏向,这种共价键叫非极性键;
不同种元素原子间,共用电子对偏向吸引电子能力强的一方,这种共价键叫极性键。
共价键可用电子式表示,也可用结构式表示。例如:
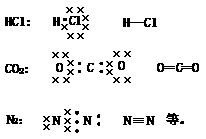
注意:(1)结构式中每一根短线仅表示一对共用电子对,也就是表示一个价键。
(2)化合物中,元素化合价数通常为得失电子数或共用电子对的偏移数。有电子得失或共用电子对偏移的化合价数又称氧化数。
1、离子键(重点是形成条件与表示方法)

注意:(1)活泼金属与活泼非金属元素间通常以离子键形成离子化合物。
(2)强碱,含氧酸盐和许多金属氧化物都是离子化合物。
(3)离子化合物中一定含离子键,还有可能含共价键。
2、原子结构,元素性质及元素在周期表的位置关系

注意:非金属元素负价数=主族序数-8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com