
题目列表(包括答案和解析)
1.可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气D.水 E.二氧化碳
Ⅰ.可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶

分析:可根据二氧化硅是不溶于水的酸性氧化物;它可跟强碱反应,不跟酸(氢氟酸除外)反应;它受热不分解等性质。而三氧化二铁,碳酸钙跟盐酸反应;硅酸、氯化铵能受热分解。通过一定操作,除去杂质。除杂过程中所发生的化学方程式如下:
(1)SiO2+2NaOH==Na2SiO3+H2O
(3)Fe2O3+6HCl==2FeCl3+3H2O
(4)CaCO3+2HCl==CaCl2+CO2↑+H2O
(5)H2SiO3 SiO2+H2O
SiO2+H2O
(6)NH4Cl NH3↑+HCl↑
NH3↑+HCl↑
答案:(1)B,④ (2)D,④,⑤ (3)A,④ (4)A,④ (5)③ (6)②
[例13] 锗是ⅣA族元素,它的单质晶体是一种良好的半导体材料,广泛用于电子工业,锗可以从燃烧的烟道灰中提取,其过程如下:
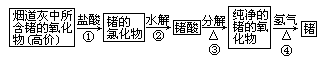
试写出上述过程中①、③、④步反应的化学方程式。
①_________________;
③_________________;
④_________________;
分析:Ge为ⅣA族,最高正价为+4价,其氧化物为GeO2,又+4价稳定,与盐酸不发生氧化还原反应,只发生碱性氧化物与酸的反应。锗酸的化学式用硅酸迁移即得:H4GeO4或H2GeO3。
①GeO2+4HCl==GeCl4+2H2O
③H4GeO4 GeO2+2H20
GeO2+2H20
(或H2GeO3 GeO2+H2O)
GeO2+H2O)
④GeO2+2H2 Ge+2H2O
Ge+2H2O
27.在干燥烧瓶中用向下排空气法收集氨气,由于空气不可能排净,所以瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积为多少?
26.有A、B、C三种一元碱,它们的式量之比为3:5:7,如果把7molA、5molB和3molC混合后,取混合物5.35g,恰好能中和0.15mol的HCl,求A、B、C的式量.
25.实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
(1)实验步骤为:
①
②
③
④
⑤
(2)所需仪器为:
(3)下列操作对所配溶液的浓度有何影响?为什么?
①为加速固体溶解,可稍加热并不断搅拌。在未降至室温时,立即将溶液转移至溶量瓶定容:
②定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度:
24.将Wg胆矾(CuSO4·5H2O)溶解在VmL水中,得到饱和溶液,测得该饱和溶液的密度为ρg/cm3,测溶液的物质的量浓度为 ,该温度下,CuSO4的溶解度为 。
23.同温同压下,同体积的氨气和硫化氢气体(H2S)的质量比为 ;同质量的氨和硫化氢气体的体积比为 ;其中含有的氢的原子个数比为 ;若二者氢原子数相等,它们的体积比为 。
22.将3.22g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为 g。
21.与16g氧气所含有分子数相同的氨气是 ,与16g氧气所含原子总数相同的氨气是 g;在相同条件下,在5.6g氮气中应添加 g氨气所组成的混合气体与16g氧气所占的体积相等。
20.同温同压下,ALCH4与H2的混合气体恰好与ALO2完全反应生成CO2和CO,则原混合气体中的平均相对分子质量为( B )
A.5.56 B.6.67 C.11.12 D.9
19.甲、乙两烧杯中,分别盛放50mL等物质的量浓度的稀H2SO4,向甲烧杯中加入mgFe粉,向乙烧杯中加入mg Zn粉,完全反应后,发现一烧杯中金属仍有剩余,若稀H2SO4的物质的量浓度为xmol/L,则x的范围应是( B )
A.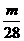 ≥x>
≥x>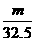 B.
B.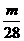 >x≥
>x≥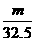
C.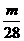 >x>
>x>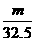 D.
D.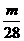 ≥x>
≥x>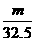
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com