
题目列表(包括答案和解析)
1.我国城市环境中的大气污染物主要是( )
A .CO、Cl2、N2、酸雨 B.HCl、O2、N2、 粉尘
C .SO2、NO2、CO、粉尘 D .NH3、CO2、NO、雾
39.CuCO3×Cu(OH)2 2CuCO3×Cu(OH)2 二者混合 36克
34.+5,7
35,(1)三,第七主族 Cl2O7(2) Na,Mg, O (3) Na2O2 (4)2OH-+ Cl2=H2O+ Cl-+ ClO-
36(1)5.43(1分) (2)C(1分) (3)D 将浓硫酸沿烧杯壁倒入盛有水的烧杯中,边倒边搅拌;冷却到室温后再用玻璃榜转移至容量瓶中;洗涤烧杯2-3次,一同转移到容量瓶中。(2分) (4)偏高(1分) (5)10.00(1分)
37(1)Mg Al Cl C(各1分) (3)CO2(1分) (4)开始产生白色沉淀 继而白色沉淀消失至无色溶液 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O(各1分)
38(1)随着原子序数增大,E值变小 周期性 (各1分 共2分)
(2)①③ (各1分 共2分)
(3)419 738 (填E(钾)、E(镁)也给分)(各1分 共2分)
(4)10号元素是氖。该元素原子的最外层电子排布已达到8电子稳定结构。(注:达到8电子稳定结构也给分)
32.Na2O,MgF2,CaCl2,K2S
33(1)CH4>NH3,H2S>HCl
(2) > ,>
(3) CFCl3(或CF3Cl)
(4)使大气臭氧层出现空洞 ABC
39、自然界存在的碳酸盐类铜矿(如孔雀石、石青等)的化学组成为aCuCO3×bCu(OH)2(a,b为正整数,且a£2,b£2)。
(1)将孔雀石、石青矿样分别加盐酸至完全溶解,耗用盐酸物质的量与产生CO2物质的量之比,孔雀石为4:1,石青为3:1。则它们的化学组成为: 孔雀石______________,石青_________________。
(2)今有一分碳酸盐类铜矿样品,将其等分为A、B两份。然后,加盐酸使A样品完全溶解,产生CO23.36L(标准状况);加热B样品使其完全分解,得到20gCuO,试计算并确定矿石的化学组成。
(3)某碳酸盐类铜矿样加酸完全溶解后,产生CO26.72L(标准状况),这份矿样中CuO含量不低于___________g。
(4)设某碳酸盐类铜矿样的质量为Ag,所含CuO质量为Gg。加酸完全溶解后,产生的CO2体积(标准状况)为V L,则含铜矿样的A、V、G之间的关系式为:A=_____________________。
1A 2C 3D 4A 5B 6C 7B 8D 9D 10C 11A 12B 13B 14B 15A
16B 17AB 18B 19B 20C 21D 22C 23B 24C 25B 26D 27BD 28B 29B
30C 31CD
38、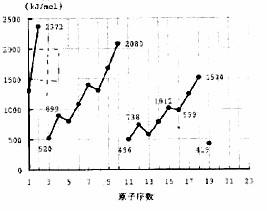 不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中吗线的变化特点,并回答下列问题。
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中吗线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:_________________.各主族中E值的这种变化特点体现了元素性质的__________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现试预测下列关系式中正确的是______(填写编号,多选倒扣)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E<_____
(4)10号元素E值较大的原因是___________________
37、短周期元素A、B、C、D中,0.5 mol A元素的离子得到 6.02×1023个电子被还原为中性原子;0.4克A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号: A B C D
(2)C一 的离子结构示意图是: ;
(3)D的最高价氧化物的化学式是:
(4)向B、C两元素形成的化合物的水溶液中逐滴滴入苛性钠溶液,叙述你所观察到的现象 , ;写出有关反应的离子方程式:
36、实验室用98.0%的密度为1.84g/mL浓H2SO4来配制100mL 1.00mol/L H2SO4。某学生操作步骤如下:A、计算需量取该种浓硫酸的体积;B、检查100mL容量瓶是否漏水;C、量取浓硫酸;D、在容量瓶中先加入少量水,然后将量取的浓硫酸缓缓注入容量瓶中,并用玻璃不断搅拌;E、再将蒸馏水注入容量瓶,至液面接近标线1-2cm时,改用滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻度线相平;F、盖紧瓶塞,反复颠倒,摇匀溶液。请回答了列问题:
(1)请你计算A中所需浓硫酸的体积为 mL。
(2)进行C步操作时,应选用下列量器中的 。
a.50mL量筒 b.25mL碱式滴定管 c.25mL酸式滴定管
(3)上述步骤中 有错,正确的操作应是 。
(4)在C步操作时,若某同学初读数时方法正确,末读数时俯视刻度线,则最终所配溶液浓度 (偏高、偏低或无影响)
(5)用配制好的溶液,再来配制50mL 0.2mol/L的硫酸,需量取原配好的溶液_________mL。
35、A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于第 周期 族,它的最高价氧化物的化学式为 。
(2)A、B、D的元素符号分别为 、 、 。
(3)A与D形成稳定化合物的化学式为 。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 。
34、在水溶液中YO3n-与S2-发生反应的离子方程式如下:
YO3n- + 3S2- + 6H+ == Y- + 3S↓+ 3H2O(已配平)
则YO3n-中Y元素的化合价为 ,Y原子的最外层电子数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com