
题目列表(包括答案和解析)
4.向溴化钠、碘化钠的混合溶液中通入足量氯气,之后加热,将溶液蒸干,并灼烧片刻,最后残留的物质是 ( )
A. NaCl B. NaCl NaBr NaI C. NaBr NaI D. NaI
3.砹是原子序数最大的卤族元素,推测砹的化合物不可能具有的性质是 ( )
A. 砹是有色固体 B. HAt很稳定
C. AgAt难溶于水 D. 砹易溶于某些有机溶剂
2.下列物质中,长期露置在空气中,不会变质的是 ( )
A. AgI B. 漂白粉 C. 食盐 D. 次氯酸钙溶液
1.下列溶液实际上不存在的是 ( )
A .氟水 B. 氯水 C. 溴水 D. 碘水
24(5分)在干燥烧瓶中用向下排空气法收集氨气,由于空气不可能排净,所以瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积为多少?
25(6分)19世纪中期,某化学家为了测定元素X的摩尔质量而选择了如下的方法:他制备了含有元素X的四种化合物A、B、C、D,并测定了每种化合物中X的质量分数。在250℃时,四种化合物都是气态。将它们分别转移至预先抽成真空的四个等容积的烧瓶中,直至每个烧瓶内的压强达到1.013×105Pa。称每个烧瓶的质量,减去空瓶的质量后可得到烧瓶内气体的质量。用氮气重复这一过程,得到如下数据表。
|
气体 |
气体的质量/g |
气体中X元素的质量分数/% |
|
N2 |
0.652 |
- |
|
A |
0.849 |
97.4 |
|
B |
2.398 |
68.9 |
|
C |
4.851 |
85.1 |
|
D |
3.583 |
92.2 |
请通过计算后确定元素X可能的摩尔质量(要求写出推算过程)。
21(6分)配制0.1mol/L盐酸溶液500mL,请按操作顺序[⑴、⑵、⑶……]填写在操作前的括号内,并在横线上填写适当的仪器名称,操作方法或数字。
( )在盛盐酸的烧杯中注入蒸馏水(溶液体积少于500mL),用玻璃棒搅拌,使其均匀混合。
( )待稀释的盐酸冷却后,沿玻璃棒注入500mL的容量瓶中。
( )用量筒量取密度为1.19g/cm3质量分数为37%的浓盐酸约(取整数) mL注入烧杯中。
( )用蒸馏水洗涤烧杯2-3次,将洗涤液注入容量瓶中。
( )往容量瓶中小心加蒸馏水至液面接近刻度________cm处,改用________加蒸馏水,使溶液__________恰好与刻度线相切。
22、(14分)为了测定某气体样品C4H10(并含有少量C3H8,均不溶于水)的平均相对分子质量,设计了下面的实验:
①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1;
②往锥形瓶中通入干燥的该气体样品,塞好胶塞,准确称量,重复操作,直至前后两次称量结果基本相同,得到质量m2;
③往锥形瓶内加满水,塞好胶塞,称量,得到质量m3。
已知实验时的温度为T(K),压强为p(kPa),水的密度为ρ水(g/L),空气的相对平均分子质量为29.0,密度为ρ空气(g/L)。回答下列问题:
⑴本实验的原理是(具体说明)________________________________________________。
⑵步骤②中为什么要重复操作,直至前后两次称量结果基本相同?
答:______________________________________________________________________。
⑶具体说明本实验中怎样做到每次测量都是在相同体积下进行的?
答:______________________________________________________________________。
⑷本实验中收集气体样品的操作,可选用的方法是(填下图中标号)___________。
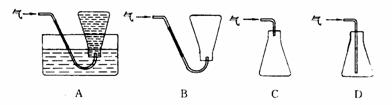
⑸锥形瓶中空气的质量(m空气)是___________________________(列出算式)。
⑹锥形瓶中样品的质量(m样品)是___________________________(列出算式)。
⑺由实验测得该气体样品的平均相对分子质量是________________________(列出算式)。
17(6分)根据反应:KClO3+6HCl==KCl+3Cl2↑+3H2O,若有0.5mol电子转移,则⑴有______molCl2生成。⑵有___________个HCl被氧化。⑶有__________个+5价Cl被还原。
18(4分)科学实验测定,每亩森林每月可吸收4kgSO2气体,如果每月按30天计算,那么每亩森林每天可吸收SO2的分子数是________________,每年可吸收SO2的物质的量是________mol。
19(3分)将3.22g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为 g。
20(8分)同温同压下,同体积的氨气和硫化氢气体(H2S)的质量比为 ;同质量的氨和硫化氢气体的体积比为 ,其中含有的氢的原子个数比为 ;若二者氢原子数相等,它们的体积比为 。
16、密度为0.910g/cm3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为 ( )
A.等于13.5% B.大于12.5%
C.小于12.5% D.无法确定
15、在KClO3+6HCl(浓)=KCl+3Cl2+3H2O的反应中,当有5摩尔电子发生转移后,被氧化的氯原子与被还原的氯原子的物质的量之比是 ( )
A、1∶5 B、5∶1 C、6∶1 D、1∶6
14、两份体积相同的某植物营养液,其配方如下:
 含
成分 含
成分量 编 号 |
KCl |
K2SO4 |
ZnSO4 |
ZnCl2 |
|
① |
0.3mol |
0.2mol |
0.1mol |
- |
|
② |
0.1mol |
0.3mol |
- |
0.1mol |
两份营养液的成分 ( )
A. n(K+)相同 B. n(Cl-)相同 C. 完全相同 D. 完全不同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com