
题目列表(包括答案和解析)
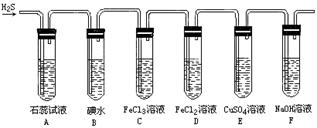
19.根据O、S、Se、Te和F、Cl、Br、I在周期表中的位置,用化学式或元素符号回答下列回题:①非金属性最活泼的元素是______。②还原性最强的离子是______。③常温下单质是液态的元素是______。④常温下气态氢化物是液态的元素是______。⑤不存在最高价态的元素是______。⑥完成以下四个化学方程式:F2+H2O_____ Cl2+H2S_____ _ Br2+H2Se______ I2+H2Te______ 根据上述四个反应的事实说明,具有相同电子层的卤素比氧族元素______。 20.标况下,4.48L氧与臭氧的混合气体,通过松节油质量增加了4.8g(松节油吸收臭氧与氧气无反应),则混合气体中氧气占______体积分数,混合物的总质量是______g。 21.同温同压下,氧气和臭氧的体积比3∶2,它们的物质的量之比为______,分子数之比为______,质量之比______,密度之比为______,原子个数之比为______,按此比例混合后,混合气体的平均相对分子质量为______,混合气体中氧气的体积分数为______,标准状况下,1L混合气体中含氧分子数为个______个. 22.将铜丝伸入硫蒸气中,观察到的现象是______,化学方程式_____ _;把铜丝加热后伸入氯气中,观察到的现象是______,化学方程式_____ _。
1.氧族元素的性质随核 电荷数增加而依次减小的是 [ ] A.单质的熔点 B.原子得电子能力 C.形成氢化物的稳定性 D.原子半径 2.氧族元素形成的氢化物其稳定性的排列顺序是 [ ] A.H2Se>H2S>H2O>H2Te B.H2O>H2S>H2Se>H2Te C.H2S>H2Se>H2Te>H2OD.H2Se>H2Te>H2O>H2S3.下列说法不正确的是 [ ] A.硫化氢比碲化氢稳定B.H2SeO3中的Se既有氧化性,又有还原性 C.硒酸钠的分子式是Na2SeO3D.硫不能导电,而碲却能够导电 4.下列单质中,通常最不易与H2化合的是 [ ]A.氧 B.硫C.硒 D.碲 5.在水溶液显酸性的下列氢化物中,最稳定的是 [ ]A.H2O B.H2S C.H2Se D.H2Te 6.在氧族元素的单质中,氧化性最强的是 [ ]A.氧 B.硫C.硒 D.碲 7.在氧族元素的下面的离子中,还原性最强的是 [ ] A.O2- B.S2- C.Se2- D.Te2- 8.下列各组物质中,其含氧酸和它的氧化物相互对应的是 [ ] A.SO2和H2SO4 B.CO和H2CO3 C.TeO2和H2TeO3 D.SeO3和H2SeO4 9.关于硒及其化合物的叙述错误的是 [ ] A.H2Se稳定性比H2S强 B.H2Se还原性比H2S强 C.H2Se能在空气中燃烧 D.H2SeO3酸性比H2SeO4弱 10.下列叙述不正确的是 [ ] A.H2S,H2Se,H2Te稳定性增强 B.H2S,H2Se,H2Te还原性增强 C.S,Se,Te氧化性减弱 D.H2S比H2Te酸性弱 11.对氧族元素叙述错误的是 [ ] A.原子最外层电子数相等B.由上而下原子半径依次增大 C.由上而下阴离子的还原性增强 D.由上而下核电荷数依次增加,核对最外层电子的吸引力也增大 12.下列微粒的还原能力强弱的顺序正确的应是 [ ] A.Cl->S2->I->Te2- B.S2->I->Cl->Te2- C.Te2->S2->I->Cl- D.I->S2->Te2->Cl- 13.以下微粒半径大小,排列正确的是 [ ] A.Se<S B.O<S C.S2->S D.O2->S2- 14.下面对氧、硫、硒、碲的叙述中正确的是 [ ] A.均可显-2,+4,+6价 B.能跟大多数金属直接化合 C.都能跟氢气直接化合 D.固体单质都不导电 15.下列微粒的还原性由小到大排列顺序正确的是 [ ] A.Cl-<Br-<I-<Se2-<S2- B.Cl-<Br-<Se2-<Se2-<I- C.Cl-<Br-<Se2-<S2-<I- D.Cl-<Br-<I-<S2-<Se2- 16.可以用两种单质直接化合而制得的物质是 [ ] A.Cu2S B.FeCl2 C.FeS D.CuS 17.能够说明硫的非金属性比氯弱的事实有: [ ]①Cl2与铁反应生成FeCl3,S与铁反应生成FeS;②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度;③将Cl2通入氢硫酸中可置换出硫;④常温时硫单质为固态而氯单质为气态。A.①③ B.①②③ C.②④ D.①②③④ 18.比较下列各组元素及化合物的性质(用大、小、强、弱来回答)。①硫的原子半径比氧______,比硒______②S2-的还原性比Cl-______比O2-______。③S的氧化性比氯______,比氧______。④硫酸的酸性比高氯酸______。
3.下列物质能由单质直接化合而制得的是( )
A.Fe2S3 B.FeCl2 C.CuS D.AlCl3
答案:D
|
|
2KNO3+S+3C====K2S+N2↑+3CO2↑,S作 剂。
答案:还原剂;氧化剂
二:臭氧
1:O3与O2物理性质的对比
|
|
O3 |
O2 |
|
色、嗅、态 |
通常为一有特殊 的淡 色气体,液态O3呈深 色,固态O3为紫 色 |
通常为一无色无气味的气体液态O2呈淡 色,固态O2 呈 雪花状,淡 色 |
|
溶解度(水中) |
大 |
小 |
|
熔点 |
- ℃ |
-
℃ |
|
沸点 |
-112.4℃ |
-183℃ |
2:同素异形体:
如O3、O2就是氧元素的同 ,我们说O3、O2互为 关系。
[思考1]钠原子(Na)和钠离子(Na+)都是由同一种元素--钠元素形成的,它们是同素异形体吗?为什么?(不是,因为Na原子和Na+是同一元素的不同粒子,不属单质。)
[思考2]Fe2O3和Fe3O4的组成元素完全相同,它们是同素异形体吗?为什么?
(不是,因为它们是由完全相同的两种元素组成的化合物。)
[思考3]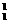 H与
H与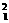 H互为什么关系?(互为同位素。)
H互为什么关系?(互为同位素。)
3:同素异形体和同位素的区别
|
|
同素异形体 |
同位素 |
|
|
定 义 |
同一种元素的不同 互称同素异形体 |
同一元素的不同 (或不同原子)互称同位素。 |
|
|
研究对象 |
单 质 |
核素或原子 |
|
|
举 例 |
O2和 ,石墨和 |
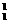 H、 ; H、 ;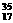 Cl和 Cl和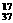 Cl Cl |
|
4:O3与O2相比,有无共性?有何差别?(二者都具氧化性,而且O3比O2有着更强的氧化性;另O3不稳定,能分解。)不稳定性:2O3====3O2
上述反应是否为氧化还原反应?为什么?(否,因无元素化合价的变化。)
造成O3与O2化学性质差别的原因是什么?(分子结构不同)
|
3O2====2O3
三:过氧化氢:(水溶液俗称 )
1:从H2O2中氧的化合价是- 及氧元素常见的化合价是 价,可理解H2O2的 性和弱 性。
|
2 H2O2==== H2O+ O2↑来分析
H2O2与MnO2混合制O2的反应有何特点?(固液,不加热) 四:氧族元素练习
2.下列结论正确的是( )
(1)粒子半径:S2->Cl>S>F (2)稳定性:HF>HCl>H2S>H2Te (3)还原性:S2->Cl->Br->I- (4)氧化性:Cl2>S>Se>Te (5)酸性:H2SO4>HClO4>H2SO3 (6)非金属性:F>Cl>S>Se
A.(2)(4)(6) B.(1)(2)(3) C.(1) D.(6)
答案:A
1.钋是原子序数最大的氧族元素,推测钋及钋的化合物最不可能具有的性质是( )
A.钋是能导电的固体 B.钋的氧化物、水化物至少有两种
C.钋与氢气不能直接化合 D.钋的氢化物很稳定
答案:D
镁元素有3种核素24Mg、25Mg、26Mg,它们的相对原子质量是23.985、24.986和25.983,原子所占的百分数依次为78.7%、10.13%、11.17%,计算镁元素的相对原子质量.
3.1.8gH216O中含的中子数等于________gD216O里所含的中子数.
1.(1)下列组成的微粒,属于原子的是________;
(2)下列组成的微粒,属于阳离子的是________;
(3)下列组成的微粒,属于阴离子的是________;
(4)下列组成的微粒,属于同一种元素的是________;
(5)下列组成的微粒,属于同位素关系的是________.
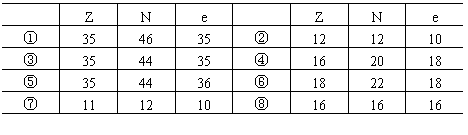

为________,气态氢化物的化学式为________.
10.互称为同位素的2种原子不可能具有的是
A.相同的电子数 B.几乎完全相同的化学性质
C.相同的中子数 D.相同的质子数
9.已知自然界中铱有2种质量数分别为191和193的同位素,而铱的平均原子质量为192.22,这2种同位素的原子个数比为
A.39∶61 B.61∶39 C.1∶1 D.39∶11
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com