
题目列表(包括答案和解析)
2、在进行过滤和蒸发时应注意哪几点?为什么?
过滤 操作要点:
“一贴”: 指用水润湿后的滤纸应紧贴 ;
“二低”指①滤纸边缘稍低于 边缘 ②滤液液面稍低于 边缘;
三靠”指①烧杯紧靠 ②玻璃棒紧靠 ③漏斗末端紧靠
蒸发 是浓缩或蒸干溶液得到固体的操作,仪器用蒸发皿、玻璃棒、酒精灯、铁架台
注意点:①在蒸发过程中要不断搅拌,以免 ②当出现 时就停止加热
③使用蒸发皿应用 夹持,后放在 上“ ④蒸发皿中溶液不超过
1、 如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因。
1、不溶性杂质的去除----过滤、蒸发
根据实验1-1填写:
A、过滤是分离 溶性固体与液体的一种方法(即一种溶,一种不溶,一定用过滤方法)
如 提纯、氯化钾和二氧化锰的分离。
B、过滤作用:除去 杂质
C、实验用品:
D、操作:1、 2. 3.
E、问题和讨论
要做到实验安全,要注意以下问题:1、 2、 3、
思考与交流:
写出你在进行实验时注意的安全问题:(不限多少)
1、 2、
3、 4、
28.用如图所示装置进行实验,将液体A逐滴加入到固体B 中,回答下列问题:
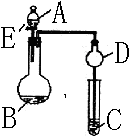 (1)图中D装置在实验中的作用是
.
(1)图中D装置在实验中的作用是
.
(2)若 A为30%H2O2溶液,B为MnO2 ,C盛有H2S饱和溶液,
旋开E后,C中的现象为 ,
C中发生反应的化学方程式为 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,
C中的现象是 ;继续通气体于C 中,
足够长的时间后,发现C中溶液的颜色消失,这 是因为在溶液中I2能被Cl2氧化为HIO3,
写出该反应的化学方程式 。
(4)该题图示装置有多种用途,若要证明SO2的还原性比Br-强,则:
A为 ,B为 ;C中盛 ,
C中现象
27.KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为:






 KClO3+ HCl(浓)= KCl + ClO2↑+ Cl2↑+
KClO3+ HCl(浓)= KCl + ClO2↑+ Cl2↑+
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
26.(1)在淀粉碘化钾的酸性溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变成蓝色,这是因为(用离子方程式表示) 。
(2)在淀粉和碘形成的蓝色溶液中,滴加Na2SO3溶液,又发现蓝色消失,这是因为 (用离子方程式表示) 。
(3)对比以上两组试验所得结果,将I2、ClO-、SO42-按氧化性由强到弱顺序排列为 。
25.在密闭容器中,将足量溴跟NaOH充分反应,发现低温时只有1/2的溴分子转化为NaBr,而加热时5/6的溴分子转化为NaBr,那么:
低温时反应方程式为 ;
加热时反应方程式为 。
24. KMnO4是常用的氧化剂。在酸性条件下,MnO4-被还原为Mn2+。试写出用KMnO4跟浓盐酸在室温下制氯气的反应的化学方程式
为 。
23.氧化还原反应方程式的配平
1) Zn+ HNO3(稀)-- Zn(NO3)2 + N2O + H2O
2) Fe(NO3)3+ NaOH+ Cl2-- Na2FeO4+ NaNO3+ NaCl+ H2O,
3) KMnO4+ KNO2+ -- Mn SO4+ K2SO4+ KNO3 + H2O
4) MnO4-+ H2O2+ -- Mn2++ H2O+ O2↑
5) KCN+ Cl2+ NaOH-- CO2+ N2+ KCl+ NaCl+ H2O
6) Cu2S+ HNO3-- Cu(NO3)2+ H2SO4+ NO +
7) Fe(OH)3+ ClO-+ = FeO42-+ Cl-+ H2O
8) KI+ KIO3+ H2SO4-- K2SO4+ I2+ H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com