
题目列表(包括答案和解析)
2.化学性质:强还原性,活泼金属.
与O2反应:常温→Na2O(白色固体)
点燃或加热→Na2O2(淡黄色固体)
与S反应:碾磨爆炸.
与水反应:剧烈.
现象:熔、浮、游、鸣、红(滴入酚酞,溶液变红)
与酸反应:非常剧烈,以致爆炸.
与某些熔融盐反应:可置换出某些熔融盐中的金属(如TiCl4等)
与盐溶液反应:实质是先与盐溶液中的水反应,然后再发生复分解反应.
1.物理性质:软、亮、轻、低、导.(软--质软,硬度小;亮--银白色金属光泽;轻--密度小,比水轻;低--熔点低;导--可导电、导热.)
结构特点: .钠原子核外有三个电子层,最外层只有一个电子,易失去一个电子变成钠离子:Na-e-→Na+,形成稳定结构.所以在化学反应中表现出强的还原性.
.钠原子核外有三个电子层,最外层只有一个电子,易失去一个电子变成钠离子:Na-e-→Na+,形成稳定结构.所以在化学反应中表现出强的还原性.
23.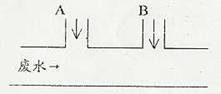 (6分)某工厂排出的废水含游离氯(Cl2)和H+的物质的量浓度分别为0.015mol/L和0.001mol/L,废水的排出速度为10.0mL/s。为除去游离氯,并使废水呈中性,某研究性学习小组的学生设计如图所示方案,在A、B两处分别注入物质的量浓度为0.1mol/L的NaOH溶液及0.15mol/L的Na2SO3溶液,以中和H+并还原Cl2。已知Cl2和Na2SO3溶液的反应为:Cl2+Na2SO3+H2O==Na2SO4+2HCl
(6分)某工厂排出的废水含游离氯(Cl2)和H+的物质的量浓度分别为0.015mol/L和0.001mol/L,废水的排出速度为10.0mL/s。为除去游离氯,并使废水呈中性,某研究性学习小组的学生设计如图所示方案,在A、B两处分别注入物质的量浓度为0.1mol/L的NaOH溶液及0.15mol/L的Na2SO3溶液,以中和H+并还原Cl2。已知Cl2和Na2SO3溶液的反应为:Cl2+Na2SO3+H2O==Na2SO4+2HCl
(1)A处注入溶液为______________,B处注入溶液与废水发生反应的离子方程式为________________ 。
(2)试计算两种溶液的注入速度(mL/s),写出计算过程。
22. (5分)市售浓硫酸中H2SO4的物质的量浓度为18.4mol•L-1,H2SO4的质量分数为98%。计算该浓硫酸的密度。
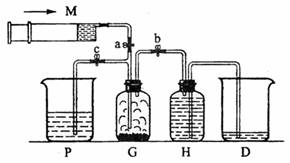
21.(8分)某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:
 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O
(1)装置H中盛放的试剂是 。
(2)尾气处理时关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。
(3)处理尾气时,发生反应的化学方程式是 。
(4)用含0.032molHCl的浓盐酸跟足量高锰酸钾固体反应,产生氯气的物质的量
应 (填“大于、等于或小于”)0.01mol。
20.(5分)欲用密度为1.18g/cm3(质量分数36.5%)的浓盐酸配制250mL1mol/L盐酸,回答下列各问:
⑴所需浓盐酸体积约为__________mL(填整数)。
⑵所需仪器为______________________________________________________。
⑶若定容时俯视,所配溶液的物质的量浓度比要求的值________(填“偏高”或“偏低”)。
⑷若定容后再摇匀静置,发现凹液面低于刻度线。此时应该(填标号)_________。
A. 直接转移到试剂瓶中 B. 加水重新定容后贮存于容量瓶中
C. 重新定容后再转移到试剂瓶中
19.(6分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-==Cu2+;还原反应为:2Fe3++2e-==2Fe3+。
⑴请据此将反应3NO2+H2O==2H++2NO3-+NO拆写为两个半反应式。
氧化反应___________________________________________;
还原反应___________________________________________。
⑵已知某一反应的半反应式CH4+10OH- -8e-==CO32-+7H2O,O2+2H2O+4e-==4OH-。则总方程式为___________________________________________________________。
18.(10分)能源可划分为一级能源和二级能源。自然界中以现成形式提供的能源称为一级能源;需依据其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(l)==2H2(g)+O2(g)-517.6kJ
⑴下列叙述正确的是 ( )
A. 电能是二级能源 B. 水力是二级能源
C. 天然气是一级能源 D. 水煤气是一级能源
⑵关于用水制取二级能源氢气,以下研究方向不正确的是 ( )
A. 构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B. 设法将太阳光聚焦,产生高温,使水分解产生氢气
C. 寻找高效催化剂,使水分解产生氢气,同时释放能量
D. 寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
⑶1mol氢气燃烧时约放热286kJ,而每kg汽油燃烧时约放热46000kJ,氢气被公认为21世纪替代矿物燃料的理想能源。试简述氢气作为能源的三个主要优点:
①_________________________________________;
②_________________________________________;
③_________________________________________。
17.(8分)向橙色浓溴水中放入过量镁粉,充分振荡后过滤,滤液呈_________色,主要反应的化学方程式为_____________________ 、_______________________
将滤液分成两份,一份中加入NaOH溶液,现象是____________ ,离子方程式
为___________________ _,另一份加入AgNO3溶液现象是___________________,离子方程式为___________________ _,此反应的一种产物见光会变黑,其原因是(用化学方程式表示)______________________________ __。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com