
题目列表(包括答案和解析)
7.23g钠溶于77g水中,所得溶液的溶质质量分数为( )
A.等于23% B.等于40% C.小于40% D.大于40%
6.由Na、Mg、Al、Fe四种金属的两种组成的混合物12.1g,与足量盐酸反应,产生H20.5g,则混合物中一定含有( )
A.Na B.Mg C.Al D.Fe
5.将一小块钠投入盛5mL澄清石灰水的试管里,不可能观察到的现象是( )
A.钠熔成小球并在液面滚动 B.有气体产生
C.溶液底部有银白色物质生成 D.溶液变浑浊
4.下列离子方程式错误的是( )
A.Na投入CuSO4溶液:2Na+Cu2+ = 2Na++Cu
B.CaCO3与盐酸反应:CaCO3+2H+ = Ca2++H2O+CO2↑
C.硫酸与Ba(OH)2反应:SO42-+Ba2++H++OH- = BaSO4↓+H2O
D.Na投入水中:2Na+2H2O = 2Na++2OH-+H2↑
3.钠与水反应的现象与钠的下列性质无关的是( )
A.钠的熔点低 B.钠的密度小
C.钠的硬度小 D.钠有强还原性
2.下列说法不正确的是( )
A.钠燃烧不一定需要氧气
B.钠加入CuSO4溶液中可置换出Cu
C.钠元素在自然界中只能以化合态存在
D.钠与硫化合生成Na2S
1.钠离子与钠原子的相同之处有( )
A.物理性质 B.元素种类 C.化学性质 D.粒子半径
3.65g 5.85g
答:所得固体质量为5.85g

[同步达纲练习]
36.5 58.5
5.4g 8g
查表知R为钠 R2O为Na2O
(2)据
2Na+2H2O = 2NaOH+H2↑ Na2O+H2O = 2NaOH
46 80 62 80
m(Na) m(NaOH) m(Na2O) m(NaOH)
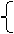
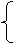 得 m(Na)+m(Na2O)=5.4g m(Na)=2.3g
得 m(Na)+m(Na2O)=5.4g m(Na)=2.3g
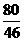 m(Na)+
m(Na)+ 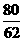 m(Na2O)=8g m(Na2O)=3.1g
m(Na2O)=8g m(Na2O)=3.1g
评析 ①通过计算求得原子量,由原子量确定是什么元素;②极端假设是解混合物计算题常用的方法.
例3 把一小块金属钠暴露在空气中,观察到以下现象:①金属钠表面逐渐变暗;②过一段时间以后又逐渐变潮湿;③再过些时候又转变成白色固体;④又过一段时间白色固体变成白色的粉末.写出以上发生的各种现象的有关化学方程式.
解析 金属钠为活泼金属,极易被空气中的氧气氧化生成氧化钠,所以表面逐渐变暗且无光泽.氧化钠在空气中溶于水,表面变潮湿而生成氢氧化钠.氢氧化钠和空气中的二氧化碳和水反应,生成碳酸钠晶体,即含有10个结晶水的碳酸钠.再过一段时间,含有结晶水的晶体风化失水,变成粉末状物质.
答 ①4Na+O2 = 2Na2O
②Na2O+H2O = 2NaOH
③2NaOH+CO2+9H2O = Na2CO3·10H2O
④Na2CO3·10H2O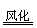 Na2CO3+10H2O
Na2CO3+10H2O
评析 该题要求写出金属钠暴露于空气中发生的一系列变化的化学方程式,实际考查的是钠及钠的化合物的化学性质.
[命题趋势分析]
碱金属是金属元素的典型代表,钠又是碱金属的代表,是高考命题的重要内容.
[典型热点考题]
例1 将4.6g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热,反应后生成的固体是( )
A.淡黄色固体混合物 B.硫粉与硫化钠
C.过氧化钠与硫化钠 D.氧化钠与硫化钠
解析:本题旨在考查钠的性质,在分析化学现象及生成物时,要考虑多种因素,不能单一回答,涉及到物质未隔绝空气时,要考虑空气中的各种成分可能参与反应.在加热条件下,钠既能与硫化合生成Na2S,也能与空气中的氧气反应生成Na2O2,而钠又是过量的,所以除生成Na2S外还有Na2O2生成.故正确选项为A、C.
答案:A、C
例2 下列叙述中不正确的是( )
A.钠原子有强还原性,钠离子有弱氧化性.
B.若电解熔融的氯化钠,则钠离子被氧化成钠原子.
C.由于钠很活泼,所以它能从溶液中置换出金属活动性顺序表中钠后面的金属.
D.钠是电和热的良导体.
解析:A.钠原子由于最外层只有一个电子且原子半径较大,所以很容易失去1个电子而形成8电子的稳定结构,其氧化产物(Na+)的氧化性也必定很弱.B.电解熔融的氯化钠,钠离子应是被还原生成钠.C.虽然钠很活泼,但由于钠可以与水反应,所以把钠投入盐溶液时不能置换出金属单质.D.正确.故本题选B和C.
例3 将同样大小的金属钠,分别投入到①MgCl2溶液、②饱和NaCl溶液、③NH4Cl溶液中,各发生什么现象?
解析:该题旨在培养学生完整描述实验现象的能力和对知识的归纳能力.金属钠分别投入到上述三种盐溶液中,首先与水反应:2Na+2H2O=2NaOH+H2↑,在①中又发生了反应Mg2++2OH-=Mg(OH)2?;在②中Na+浓度增大,而水的量减少,故有NaCl晶体析出;在③中又发生了反应NH4++OH-=NH3·H2O,而反应放热,故有NH3放出.
答案:在三种溶液中的共同现象是:钠浮在液面上,熔成小球,迅速游动,并发出“咝咝的声音,最后消失;不同之处是:①中有白色沉淀,②中溶液变浑浊,③中有刺激性气味的气体放出.
例4 在进行钠和水的反应实验中,有如下操作和实验现象,请根据钠的性质解释说明.
(1)刚用小刀切开的金属钠断面呈什么颜色?在空气中放置几分钟又有什么变化?
(2)切下来的金属钠块要用滤纸擦净后方可放入水中实验,这是为什么?
(3)金属钠块必须用镊子夹取,为什么不能用手指拿取?
(4)金属钠块投入水中后,为什么很快会熔成银白色小球并浮于水面上?
(5)钠小球为什么会在水面上往返游动?
(6)如果水中在未加钠之前已滴入酚酞试液,反应后颜色会有什么变化?为什么?
解析:本题旨在考查学生对化学问题理解深度的高层次的试题,内涵丰富,不但要回答出“是什么”,还要回答出“为什么”.要注意认真审题,思维逻辑要清楚,文字表述要简练而准确.
答案:(1)切开金属钠后断面呈银白色并有金属光泽.空气中放置几分钟后表面会逐渐变暗,这是由于钠被空气中的氧气缓慢氧化所致.
(2)因金属钠贮存在煤油里,切下的钠表面附有煤油,需用滤纸擦净,这样可以防止钠块与水反应放热而造成煤油燃烧.
(3)用手拿取金属钠,会使手指表面的水分与钠反应,生成的强碱NaOH腐蚀皮肤.
(4)因为钠的密度比水小,故浮于水面.又因钠与水反应放出的热量使钠熔化为液态,也说明金属钠的熔点较低.在表面张力的作用下,浮于水面的液态钠就形成小液球.
(5)金属钠与水反应,钠球与水接触的部位会放出氢气,会推动钠小球在水面运动.由于小球不同方向受力不均,故往返进行无规则游动.
(6)由于钠与水反应生成氢氧化钠和氢气,这样使溶液呈碱性,则酚酞变红色.
例5 有一在空气里暴露过的NaOH固体,经分析知其含水7.65%,含Na2CO34.32%,其余是NaOH.若将1g该样品放入含有HCl3.65g的盐酸中使其完全反应后,残酸再用50g2%的NaOH溶液恰好中和完全.蒸发所得溶液至干,计算所得固体质量是多少克?
解析:对分析问题能力较弱的同学来说,本题数据众多、反应物不纯,多步反应等干扰条件具有相当强的迷惑性,它会搅乱学生的思维,使学生身不由己地走入圈套,去一步一步从头分析,多次计算,结果花时间费工夫,还不一定能正确解答.本题若认真分析,就会发现,最后所得固体物质为NaCl,则可由氯元素质量守恒快速解题:
HCl - NaCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com