
题目列表(包括答案和解析)
1.灼热的铜丝放入盛有氯气的集气瓶内,发生化学反应后,再向集气瓶中注入少量水可观察到的现象是( )
A.棕色的雾 B.棕色的烟 C.绿色溶液 D.棕色溶液
7.3g yg
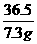 =
=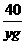 解得y=8<12
解得y=8<12
故NaOH过量,溶液呈碱性,石蕊变蓝色.
答案 蓝色
例5 下图表示在没有通风橱收集纯净的氯气时设计的装置图,图中A、B是可控制的弹簧铁夹.
(1)烧杯中盛放的液体是 ;其作用是 ;水槽中应盛放的液体是 .
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应 ,当氯气纯度合乎要求时,应 ,当氯气取集完毕时,应 .
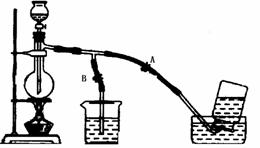
解析 (1)因为Cl2有毒,实验时又没有通风橱,所以多余的Cl2一定要用溶液吸收.烧杯中盛放的液体是NaOH溶液,其作用是吸收多余的Cl2.因为Cl2可溶于水且与水反应,所以Cl2不能用排水法收集,而要用排饱和食盐水法收集,所以水槽中盛放的液体是饱和食盐水.
(2)当刚产生氯气时,打开B夹,关上A夹.当氯气纯度合乎要求时,应打开A夹,关闭B夹,当氯气收集完毕时,应关闭A夹,打开B夹.
答案 (1)NaOH溶液 吸取多余的氯气 饱和食盐水 (2)打开B夹,关上A夹 应打开A夹,关闭B夹 关闭A夹,打开B夹.

[同步达纲练习]
36.5 40
19.6g xg
 =
=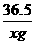 解得x=7.3
解得x=7.3
又设7.3gHCl与ygNaOH恰好反应,有
HCl+ NaOH = NaCl+H2O
2.化学现象中的烟、雾、气的区别
(1)烟:大量细小固体颗粒分散在气体中的现象.例:Cu在Cl2中燃烧生成(CuCl2)棕黄色烟.
(2)雾:大量细小液滴分散在气体中.例如HCl气体在空气中遇水蒸气生成的雾(盐酸小液滴).
(3)烟雾:大量细小固体颗粒与大量细小液滴同时分散在气体中的现象.例如:磷在氯气中燃烧生成PCl3、PCl5的混合物的现象.
(4)气:是指气态物质.若气体无色,则肉眼看不到,若有色才能观察到.
[难解巧解点拨]
例1 下列常用的干燥剂中,不能干燥氯气的是( )
A.浓H2SO4 B.碱石灰 C.磷酐 D.无水氯化钙
分析 淘汰法.作干燥剂的物质必须具备两个条件:(1)本身具有很强的吸水性;(2)不能与被干燥的物质发生反应.碱石灰是NaOH和CaO的混合物,能与Cl2发生反应,故答案选(B).
例2 下列各种化合物中,含氯质量分数为47.65%的是( )
A.HCl B.AgCl C.NaCl D.KCl
分析 估算法.由题意知,含氯量为47.65%,接近一半,所以选项中化合分子式里除氯外的另一元素的含量也接近一半(但稍大),原子量应稍大于氯的原子量(35.5).观察各元素的原子量:H:1 Ag:108 Na:23 K:39,便可确定答案为D.
例3 自来水可以用氯气消毒.某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是( )
A.AgNO3 B.FeCl2 C.Na2SO3 D.AlCl3
分析 分析法.用氯气消毒的自来水中,含有少量的氯,具有氧化性,能氧化还原性物质,水里含有一定量氯离子.自来水中存在的Cl2可发生下列反应:Cl2+H2O+Ag+ =H-+AgCl↓+HClO,2Fe2++Cl2 = 2Fe3++2Cl-,Cl2+SO2-3+H2O = 2H++2Cl-+SO2-4,故答案为D.
[课本难题解答]
P72 七 2. AgNO3+HCl=HNO3+AgCl↓,1mol
HCl生成1molAgCl沉淀,n(HCl)=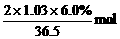
=0.034mol
n(AgCl)=0.0034mol,m(AgCl)=0.0034×143.5g=0.49g
[典型热点考题]
例1 下列各化合物不能直接由单质间化合制取的是( )
A.FeCl3 B.CuCl2 C.AlCl3 D.FeCl2
解析 因Cl2化学性质很活泼,与可变价态金属反应时生成高价态化合物,Fe元素有+2价,+3价,Cu元素有+1价,+2价,Al元素只有+3价,所以选D.
答案 D
例2 在反应6HCl+KClO3=KCl+3Cl2↑+3H2O中,被氧化的氯元素与被还原的氯元素的物质的量之比是( )
A.5∶1 B.6∶1 C.3∶1 D.1∶6
解析 此反应中,KClO3是氧化剂,氯元素被还原;HCl是还原剂,氯元素被氧化.氧化和还原发生在同种元素之间.对此类反应,应注意所谓“交错原则”:即发生此类反应时,氧化产物中被氧化的元素的化合价不得高于还原产物中被还原的同种元素的化合价.因此,KClO3的还原产物是Cl2而不是KCl,否则,就会出现“交错”现象.
答案 A
例3 下列关于氯水的叙述正确的是( )
A.新制的氯水中只含有Cl2和H2O分子
B.新制的氯水可使蓝色石蕊试纸先变红后变白
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后PH值会变小
解析 新制的氯水中含有H2O、Cl2、HClO、H+、Cl-、ClO-等,光照氯水产生的气体是O2(2HClO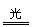 2HCl+O2↑),故(A)、(C)选项不符合要求.
2HCl+O2↑),故(A)、(C)选项不符合要求.
氯水中的H+可使石蕊变红,HClO具有漂白性可使石蕊褪色,前者反应速率较快,后者反应速率较慢,故先变红后褪色(变为纸的本色--白色);氯水放置数天后,因HClO不稳定且为弱酸,慢慢分解生成O2和盐酸(强酸),溶液酸性增强了,PH值会变小.因此(B)、(D)选项符合题意.
答案 B、D
例4 将固体NaCl放入浓H2SO4,用酒精灯加热.反应过程中消耗19.6g硫酸.将生成的HCl通入60g质量分数为20%的NaOH溶液中,若滴入石蕊试液,溶液呈 色.
解析 判断过量问题计算的前提是:首先必须正确写出有关反应的化学方程式,一旦原理错,则会导致步步错.
此题用酒精灯加热达不到强热温度,故NaCl和浓H2SO4按下式发生反应:
NaCl+H2SO4(浓) NaHSO4+HCl↑.根据生成HCl的质量和NaOH的质量[60×20%=12(g)]判断谁过量,即可知滴入石蕊后溶液呈什么颜色.
NaHSO4+HCl↑.根据生成HCl的质量和NaOH的质量[60×20%=12(g)]判断谁过量,即可知滴入石蕊后溶液呈什么颜色.
设19.6g浓H2SO4跟NaCl反应生成HClxg,有
NaCl+ H2SO4(浓)  NaHSO4+ HCl↑
NaHSO4+ HCl↑
98 36.5
任何一种物质的用途与其性质是分不开的.
氯气的用途和性质关系
|
氯气的用途 |
氯气的性质 |
|
漂白剂 |
Cl2与水反应生成 |
|
消毒剂 |
的HClO具有强氧化性 |
|
工业上合成盐酸 |
H2与Cl2反应生成HCl |
|
制漂白粉 |
Cl2与Ca(OH)2反应 |
|
制农药 |
Cl2与P反应生成的PCl3可用于制农药 |
|
制氯仿(CHCl3) |
Cl2与CH4反应 |
[重点难点解析]
1.氯水的成分和性质
(1)氯水的成分
氯水是氯气的水溶液,通常情况下为浅黄色溶液,氯水中只有部分Cl2与水反应,其化学方程式为:
Cl2+H2O HCl+HClO
HCl+HClO
新制的氯水中含Cl2、H2O、HClO等分子和H+、Cl-、ClO-、OH-等离子.
(2)氯水的性质
氯水具有多种物质的性质:Cl2、HClO具有强氧化性,HCl具有强酸性,HClO具有弱酸性……
氯水的性质比较复杂,有可能存在多种成分同时作用于一种物质.在一般情况下,认为是溶液中氯分子的性质.若为盐酸或次氯酸的性质,主要有下面几种情况.
①作为盐酸的性质:当与弱酸的盐或硝酸银溶液作用时,主要作为盐酸性质,例如:
氯水与Na2CO3溶液反应:
Cl2+2H2O HCl+HClO
HCl+HClO
2HCl+Na2CO3 = 2NaCl+CO2↑+2HclO
氯水与AgNO3溶液反应:
Cl2+H2O HCl+HClO
HCl+HClO
HCl+AgNO3→AgCl↓+HNO3
总方程式:Cl2+H2O+AgNO3 = AgCl↓+HClO+HNO3
注意:不是形成AgClO,因HClO是弱酸,且次氯酸的盐类溶于水,不能生成沉淀.
②作为次氯酸的性质:当氯水用于漂白(与有机化合物色素作用)、消毒、杀菌,溶液的保存和溶液酸性的变化等.利用的化学性质是强氧化性和不稳定性.
③要注意液氯与氯水的区别:液氯是纯净物,成分是Cl2分子,而氯水是混合物.
(1)装置图

(2)药品:MnO2和浓盐酸 (稀盐酸则难以发生)
(3)原理:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)主要仪器:①分液漏斗 ②洗气瓶(长进短出)
③尾气吸收装置(因Cl2有毒污染空气):本气体发生装置为三大发生装置之一,适用于固体(或液体)与液体在加热条件下制气体的实验.
(5)收集方法:利用Cl2密度比空气密度大且能溶于水,难溶于饱和食盐水,可用向上排空气法或排饱和食盐水法.
(6)净化:因浓HCl有挥发性,制的Cl2中常混有HCl、H2O杂质,常用饱和食盐水除HCl,用浓H2SO4加以干燥Cl2.
(7)检验:湿润的KI淀粉试纸.
用HNO3酸化的AgNO3溶液
Ag++Cl- = AgCl↓ 白色
5.与某些具有还原性的物质的反应 如
Cl2+2KI = 2KCl+I2 (可用湿润的KI试纸来检验Cl2)
2FeCl2+Cl2 = 2FeCl3
Cl2+Na2SO3+H2O = Na2SO4+2HCl
4.与碱反应
Cl2+2NaOH = NaClO+NaCl+H2O (尾气处理)
工业上用Cl2与石灰乳作用制漂粉精:
2Cl2+2Ca(OH)2
= 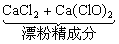 +2H2O
+2H2O
漂白原理:Ca(ClO)2→HClO起漂白杀菌作用的是HClO
Ca(ClO)2+H2O+CO2 = CaCO3↓+2HClO (空气中)
Ca(ClO)2+2HCl = CaCl2+2HClO (加酸可加速漂白)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com