
题目列表(包括答案和解析)
25.(1) (2) (3)
24.(1) ; (2) 。
23.(1) ;(2) (3)
22.(1) (2) (3) (4) (5)
21.(1) (2) (3)
(4) (5)
30、(6分)SiO2和CaCO3的混合物26g,在高温下加热到质量不再改变,冷却后称质量为17.2g.
(1)写出可能发生反应的化学方程式;
(2)求产生的气体在标准状况时的体积;
(3)求原混合物中的SiO2的质量.
高一年级教学质量检测(模拟卷)
学校 班级 姓名 学号 座位号
29、(6分)完成下列基本计算:
(1)与16g氧气所含原子总数相同的氨气是 g。
(2)在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为 。
(3)200mL 0.5mol/L盐酸与13.4g Na2CO3·xH2O恰好完全反应,则x的值为 。
28、 (8分)右图是氢氧化钠试剂标签上的部分数据。两位同学欲测定该试剂是否为合格产品。
(8分)右图是氢氧化钠试剂标签上的部分数据。两位同学欲测定该试剂是否为合格产品。
(1)甲同学的做法是:
① 将2.00g该试剂溶于水配成250mL溶液,所需的主要仪器除玻璃棒、胶头滴管外,还须玻璃仪器有_____________、__________________。
② 取上述溶液25.00mL放入锥形瓶中,加几滴酚酞作指示剂,用0.20mol·L-1的标准盐酸滴定至终点(其它杂质不与盐酸反应,下同)。假定其它步骤都合理正确。请你分析根据消耗盐酸的体积__________(填“能”或“否”)测出NaOH的含量,说明理由:
__________________ ___________________。
(2)乙同学设计的实验方案是:
① 将2.00g该试剂溶于适量的水,加入足量的BaCl2溶液,充分反应后,过滤、洗涤,将洗涤液与滤液合并,再稀释到250mL。
② 取上述溶液25.00mL放入锥形瓶中,加几滴酚酞作指示剂,用 0.2000 mol·L-1的标准盐酸滴定至终点。若消耗标准盐酸的体积为24.70mL,该试剂是否为合格产品__________(填“合格”或“不合格”),氢氧化钠质量分数为 。
27、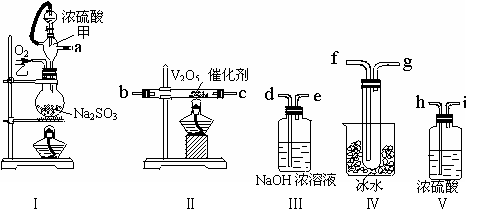 (8分)已知SO3是一种没有颜色的固体,熔点为16.8℃,沸点为44.8℃。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率。
(8分)已知SO3是一种没有颜色的固体,熔点为16.8℃,沸点为44.8℃。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率。
(1)这些装置的连接顺序(按气体从左到右的方向是______→______→______→______→______→______→______→______ (填各接口的编号)
(2)实验时甲仪器的作用是 ,甲仪器具有该作用的原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________。
(4)Ⅳ处观察到的现象是______________________。
(5)用nmolNa2SO3粉末与足量浓硫酸进行实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重mg,则本实验中SO2的转化率为______________________________。
26、(7分)我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:
|
测试时间/h |
0 |
1 |
2 |
3 |
4 |
|
雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析数据,回答以下问题:
a.雨水样品的pH变化的原因(用化学方程式表示):
b.如果将刚取样的上述雨水和自来水混和,pH将变 。(填“大”、“小”、“不变”)原因(用化学方程式表示)
(2)你认为减少酸雨产生的途径可采用的措施是 。
①少用煤作燃料 ②把工厂烟囱造高 ③燃烧脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①②⑤ D.①③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com