
题目列表(包括答案和解析)
16.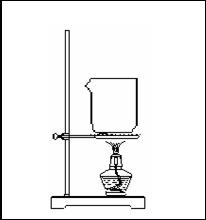 (18分)课本中有这样一段:“苯通常是无色、带有特殊气味的液体,有毒,不溶于水,密度比水小,熔点为5.5℃,沸点为80.1℃。”某同学欲探究苯与水沸点的高低,设计了如下的实验装置:
(18分)课本中有这样一段:“苯通常是无色、带有特殊气味的液体,有毒,不溶于水,密度比水小,熔点为5.5℃,沸点为80.1℃。”某同学欲探究苯与水沸点的高低,设计了如下的实验装置:
⑴请你在方框内补全该同学的装置图,
指出仪器中所盛试剂的名称。
⑵该同学根据实验中出现
的现象来判断苯与水沸点的高低。
⑶写出实验室中制取硝基苯的反应式:
。
⑷写出碳原子的基态电子排布式
苯分子中碳原子的杂化形式为
在苯分子中共有 个σ键,
苯分子的构型为
苯的熔沸点比水的溶沸点低的原因是
15.下列反应原理中,不符合工业冶炼金属实际情况的是
A.2HgO 2Hg+O2↑
B.2Al+3MnO2
2Hg+O2↑
B.2Al+3MnO2 2Al2O3+3Mn
2Al2O3+3Mn
C.2MgO 2Mg+O2↑ D.4CO+Fe3O4
2Mg+O2↑ D.4CO+Fe3O4 3Fe+4CO2
3Fe+4CO2
第Ⅱ卷(非选择题 共90分)
14.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂。常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得,下列有关说法正确的是
A.S2Cl2分子空间构型为正四面体形
B.固态时S2Cl2属于原子晶体
C.S2Cl2水解的化学方程式可能为:2S2Cl2 +2H2O== 4HCl + SO2↑ + 3S↓
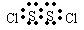 D.S2Cl2的电子式为:
D.S2Cl2的电子式为:
13.天然气根据成分不同分为贫气和富气,贫气中甲烷的含量较多,富气中乙烷、丙烷、丁烷的含量相对高一些。若要将它们液化,下列说法正确的是
A.贫气易液化 B.富气易液化
C.二者液化条件相同 D.加压降温均有利于两者液化
12.从海水里提取溴的过程中,有如下反应:
5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与上述反应在原理上最相似的反应是
A.2NaBr+Cl2=Br2+2NaCl B.Br2+SO2+2H2O=2HBr+H2SO4
C.2H2S+SO2=3S+2H2O D.Cl2+H2O=HCl+HClO
11.关于原子轨道的说法正确的是
A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
10. 以下现象与核外电子的跃迁有关的是①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
9.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3C  2AlN + 3CO下列叙述正确的是
2AlN + 3CO下列叙述正确的是
A.氮化铝是一种平面层状结构的晶体
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
D.氮化铝晶体属于原子晶体
8.键能是指破坏(或形成)1 mol化学键所吸收(或放出)的能量。化学反应就是旧键断裂和新键形成的过程。现查得:H-H、Cl-Cl和H-Cl的键能分别为436、243和431 kJ· mol-1,请用此数据估计,由Cl2、H2生成1 mol HCl时的热效应
A.放热183kJ B.放热91.5kJ
C.吸热183kJ D.吸热91.5kJ
7.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com