
题目列表(包括答案和解析)
2、某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键
A.一定是离子键 B.一定是共价键
C.可能是离子键,也可能是共价键 D.以上说法都不正确
1、 一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是
A. 硫酸与水 B.生石灰与水 C.熟石灰与水 D.氯化钠与水
4.28×10-10m。求
(1)FexO中x值(精确至0.01)为多少?
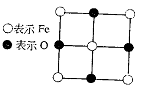 (2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
(3)在完整晶体中,与O2-等距且最近的6个Fe占据空隙是何种几何形状?
(4)在晶体中,铁元素的离子间最短距离为多少米?
第二学期高一年级期末模拟考试
23.(10分)已知Fex O晶体晶胞结构为NaCl型(其晶胞的一个面如图),由于晶体缺陷,x值小于1。测知Fex O晶体密度ρ为5.71 g·cm-3,晶胞边长为:
22.(6分)现用30g普通冰醋酸(CH3COOH)与28g含有18O的乙醇(CH3CH218OH)在浓硫酸存在的条件下加热制取乙酸乙酯,如果实际产量是理论产量的80%,可制取乙酸乙酯多少克?
21.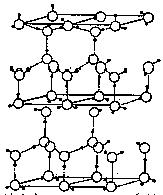 (10分)水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体,其结构示意图如图所示
(10分)水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体,其结构示意图如图所示
⑴1 mol冰中有 mol“氢键”
⑵水分子可电离生成两种含有相同电子数的微粒,其电离方程式为: 。
⑶在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德华力(11kJ•mol-1)。已知冰的升华热是51 kJ•mol-1,则冰晶体中氢键的能量是 kJ•mol-1
⑷用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是 ,其判断依据是_______________________________。
20.(8分)下表是三个不同短周期部分元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.070 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
试回答下列问题:
⑴五种元素中原子半径最大的元素在周期表中位于 。
⑵写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应:
;
②R2X2与ZX2反应:
。
⑶X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e-结构,且含有非极性键)的电子式 。
19.(10分)某有机物A由C、H、O三种元素组成,15g A完全燃烧可生成22g CO2 和9g水。试求:
⑴该有机物的最简式 。
⑵若符合该最简式的A物质可能不止一种,则它们之间的关系 (填序号)
A. 一定互为同系物 B. 一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D. 等物质的量的它们完全燃烧耗氧量相同
⑶若A与碳酸钠溶液反应有气体放出,则该反应的化学方程式为:
。
⑷若A是具有水果香味的液体,可发生水解反应,则A的结构简式为 。
⑸若A的相对分子质量为180,能发生银镜反应,也能发生酯化反应,则A的分子式为 。
18.(14分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期中金属性最强的元素。试回答下列问题:
⑴A在元素周期表中的位置_______________;
⑵D元素的名称是 ,该元素的最高价氧化物的化学式为 ;
⑶A、B、C三种元素形成的简单离子的半径由大到小的顺序是_______________(填写离子符号);
⑷CA2与D元素的单质在水溶液中反应的离子方程式是__________________;
⑸C元素常见的化合价有-2、+2、+4、+6等,C与A、B、D形成的很多化合物中,各原子(或离子)都满足最外层8电子稳定结构,请你大胆猜想,写出其中两种化合物的化学式 _________、___________;
⑹选择⑸中的一个答案,用电子式表示其形成过程:
。
17.(14分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
⑴一般地,同一主族的元素最外层电子数相同,其单质及其对应的化合物具有相似的性质。下列关于同主族元素所形成物质的推理中不正确的是 ;
A.Na与Cl2反应能形成离子键,故K与Cl2反应也能形成离子键
B.Cl2能置换出NaBr溶液中的溴,故Br2能置换出NaI溶液中的碘
C.Li在氧气中燃烧生成Li2O,故Na在氧气中燃烧生成Na2O
D.C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在
E.所有主族元素的原子形成简单阳离子时的正价数都与它的族序数相等
⑵表中N元素形成的单质的电子式为 ;
As的原子结构示意图是 ;
|
|
|
||||
|
|
C |
N |
O |
F |
|
|
|
Si |
P |
S |
Cl |
|
|
|
Ge |
As |
Se |
Br |
|
|
|
Sn |
Sb |
Te |
I |
|
|
|
Pb |
Bi |
Po |
At |
|
⑶根据元素周期律,请你预测:
H3AsO4、H3PO4的酸性强弱 > ; As、Se气态氢化物的稳定性 > ;
⑷现有某非金属元素R,若其原子最外层电子数为x,写出R形成的简单阴离子的化学式 ;
⑸在一定的条件下,S与H2反应有一定的限度(可理解为反应进行的程度),请判断在相同的条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com