
题目列表(包括答案和解析)
29、(14分)胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:

pH值控制可参考下列数据
|
物 质 |
开始沉淀时的pH值 |
完全沉淀时的pH值 |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
⑴ A物质可选用___________(填字母)。
a.稀H2SO4 b.浓H2SO4/ D c.浓FeCl3溶液 d.浓HNO3
⑵ I中加H2O2的目的_____________________________________________。
⑶ II中加Cu2(OH)2CO3的目的是___________________________________________;
其优点是____________________________________________________________。
III加热煮沸时发生的化学反应的离子方程式为________________________。
V中加H2SO4调节pH=1是为了____________________________________________。
某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是
。
若你是该工程师,将对所加的A物质作何改进?请提出建议_______________
。
28、(12分)A、B、C、D四种物质都是短周期非金属气体单质,且A是氧化性最强的单质。在一定条件下,A、B、C分别跟D发生化合反应生成相应的共价化合物甲、乙、丙,每个甲、乙、丙的分子中都含有10个电子。B与C在放电条件下能化合生成丁,且丁和丙都含有同一种元素。这些单质和化合物之间在一定条件下可发生如下图所示的相互转化关系:
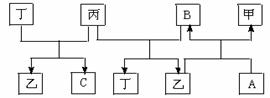
据此,回答下列问题:
⑴写出下列物质的电子式:C_______甲________。
⑵ 写出下列反应的化学方程式:
①乙+A→甲+B _____________________________________________;
②丁+丙→乙+C _____________________________________________;
⑶ 甲、乙、丙三种物质中稳定性由强到弱的顺序是______________________。
判断依据是_________________________________________。
27、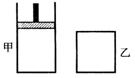 (9分)一定温度下,分别往容积均为5L的甲(恒压容器)、乙(恒容容器)中加入0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到2s时,则得
(9分)一定温度下,分别往容积均为5L的甲(恒压容器)、乙(恒容容器)中加入0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到2s时,则得
乙容器中N2O4 的浓度为0.09mol·L-1。经过60s,乙容器中反应
到平衡。(反应过程中两个容器的温度均保持恒定)
⑴ 出现红棕色的原因(用化学方和式表示)是:
⑵前2s内乙容器中以N2O4的溶度变化表示的反应速率为 。
⑶达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,以下同);容器内的N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
⑷若要使甲、乙中N2O4浓度相等,不能采取的措施是 (填选项的标号)。
A.保持温度不变,适当压缩甲容器体积
B.保持容器体积不变,使甲容器升温
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
26、(8分)(用化学式填空)在空气中:将氯化铁溶液蒸干并灼烧得到的固体物质____________;碳酸氢钠溶液蒸干得到的固体物质_____________;硫酸铝溶液蒸干得到的固体物质_____________;亚硫酸钠溶液蒸干得到的固体物质__________。
25、(13分)用中和滴定法测定某烧碱的纯度。
⑴配制待测液:将1.7g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所用的主要仪器有________________________________________。
⑵滴定:①盛装0.20mol/L盐酸标准液应该用_______式滴定管,滴定管洗涤干净的标准是____________________________________________________________________。
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视__________________,滴定终点时,锥形瓶中的溶液的颜色变化是(选序号)_________。
A、由黄色变为红色 B、由黄色变为橙色 C、由浅红色变为无色 D、由无色变为红色
③有关数据记录如下:
|
滴定序号 |
待测液体积(ml) |
所消耗盐酸标准液的体积(ml) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.70 |
|
2 |
20.00 |
6.00 |
26.00 |
⑶纯度计算:
NaOH溶液的浓度为______________mol/L,烧碱样品的纯度为____________。
⑷对几种假定情况的讨论:(填无影响、偏高、偏低)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果_________________。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果_________。
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果_________。
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果_________________。
24、将0.1mol/L的CH3COONa溶液20mL与0.1mol/LHCl溶液10mL混合后,溶液显酸性,则溶液中有关粒子浓度关系正确的是
A、c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
B、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C、c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
D、c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
江苏省通州高级中学2004-2005年度(上)
高一实验班期终调研测试
第 二 卷(非选择题78分)
选择题答案:
23、弱电解质的电离存在着电离平衡,当达到电离平衡时,已电离的分子数占弱电解质总分子数的百分比称为电离度。在25℃时,pH=4的盐酸和氯化铵溶液中,水的离子积(Kw)和电离度(HCl和NH4Cl分别用αA和αB表示)的叙述正确的是
A、Kw相等,αB ==αA B、Kw不等,αB ==11αA
C、Kw相等,αB == αA D、Kw相等,αB ==
αA D、Kw相等,αB ==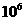 αA
αA
22、100℃时水的离子积Kw=1×10-12。这时将等体积硫酸和氢氧化钠溶液混合,若溶液混合后显中性,则混合前硫酸的pH和氢氧化钠溶液的pH之和为
A、12 B、14 C、13 D、15
21、在容积一定的密闭容器中,可逆反应A2(g)+ B2(g) xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率 B.P3<P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度D.P3>P4,Y轴表示混合气体的平均摩尔质量
20、将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A、c(HCN)<c(CN-) B、c(Na+)>c(CN-)
C、c(HCN)-c(CN-)=c(OH-) D、c(HCN)+c(CN-)=0.1mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com