
题目列表(包括答案和解析)
2.已知钍(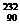 Th)的原子可发生下列放射性变化:
Th)的原子可发生下列放射性变化: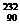 Th-→
Th-→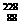 X+
X+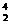 He。对元素X的推测错误的是( )
He。对元素X的推测错误的是( )
A. X原子核外有6个电子层 B. X的碳酸正盐不溶于水
C. X的最高正价为+2价 D. X的氢氧化物是一种两性氢氧化物
1.氡是放射性稀有气体元素,氡气吸入体内有害健康,氡的核电荷数是86,相对原子质量是222。科学家还发现某些放射性矿物分解放出的“锕射气”,是由质子数86,质量数219的原子组成,下列有关氡的说法正确的是( )
A.氡气在标准状况下密度约是19.82g/L
B.氡气化学性质较活泼,因此对人体有害
C.氡原子核外有7个电子层,最外层有8个电子
D.“锕射气”是氡的同位素
12.A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F
三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的符号:A____________,B____________,E____________。
(2)B的单质在F的单质中燃烧的现象是___ _________,
化学方程式是 _。
(3)A、C两种元素的最高价氧化物的水化物反应的离子方程式是
__。
第三节 元素周期表(课时四)
11.某元素的最高价氧化物分子式R2O5,已知R的气态氢化物中含氢8.82%,则R的原子量约为______,它位于周期表中第______周期,第____族,它的最高价氧化物对应水化物的分子式为___ _,与同周期的相邻元素相比,它的酸性比____ _弱,比__ _强。
10.天然存在的金属钫(Fr)极微量。它的21个已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是( )
A.已知元素中具有最大的原子半径 B.在空气中燃烧时生成氧化物Fr2O
C.氧化物对应的水化物是极强的碱 D.其单质的熔点比金属钠的熔点高
8.科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第7周期IVA族,称为类铅。关于它的性质,预测错误的是( )
A.它的最外层电子数为4 B.它的金属性比铅强
C.它具有+2、+3、+4价 D.它的最高价氧化物的水化物是强酸
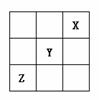 9.短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
9.短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.1molX的单质跟足量水反应时,发生转移的电子为2mol
D.Y的氢化物稳定性大于Z的氢化物稳定性
7.运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)是一种轻金属,它的氧化物对应的水化物可能具有两性
B.砹是一种有色固体,HAt很不稳定,AgAt是有色、难溶于水且感光性很强的固体
C.硫酸锶(SrSO4)是难溶于水和盐酸的白色固体
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体物质
6.铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同主族元素,元素符号是Tl,以下对铊的单质及其化合物的性质推断不正确的是( )
A.铊是易导电的银白色金属 B.铊能生成+3价的阳离子
C.氢氧化铊是两性氢氧化物 D.Tl3+的氧化能力比Al3+强
5.下列说法错误的是( )
A. 作半导体材料的元素大多数位于周期表中金属和非金属的交界处
B. 农药中常含有的元素通常在元素周期表的右上方区域内
C. 作催化剂材料的元素通常在元素周期表的左下方区域内
D. 在周期表过渡元素中可寻找到耐高温和耐腐蚀的合金材料
4.下表是X、Y、Z三种元素的氢化物的某些性质
|
元素 |
熔点/℃ |
沸点/℃ |
与水的反应 |
导电性(纯液体) |
|
X |
-283 |
-162 |
不反应 |
不导电 |
|
Y |
-102 |
19 |
放热反应,形成酸性溶液 |
不导电 |
|
Z |
680 |
/ |
剧烈反应,生成H2,并形成碱性溶液 |
导电 |
若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是( )
A.X、Y、Z B. Z、X、Y C.Y、X、Z D.Z、Y、X
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com