
题目列表(包括答案和解析)
7.元素金属性和非金属性强弱的判断方法
|
金 属 性 比 较 |
本质 |
原子越易失电子,金属性越强。 |
|
判 断 依 据 |
1.在金属活动顺序表中越靠前,金属性越强。 |
|
|
2.单质与水或非氧化性酸反应越剧烈,金属性越强。 |
||
|
3.单质还原性越强或离子氧化性越弱,金属性越强。 |
||
|
4.最高价氧化物对应水化物的碱性越强,金属性越强。 |
||
5.若xn++y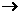 x+ym+ 则y比x金属性强。 x+ym+ 则y比x金属性强。 |
||
|
非 金 属 性 比 较 |
本质 |
原子越易得电子,非金属性越强。 |
|
判 断 方 法 |
1.与H2化合越易,气态氢化物越稳定,非金属性越强。 |
|
|
2.单质氧化性越强,阴离子还原性越弱,非金属性越强。 |
||
|
3.最高价氧化物的水化物酸性越强,非金属性越强。 |
||
4.An-+B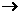 Bm-+A 则B比A非金属性强。 Bm-+A 则B比A非金属性强。 |
6.简单微粒半径的比较方法
5.元素周期律
|
涵 义 |
元素性质随着元素原子序数的递增而呈周期性变化。 |
|
实 质 |
元素性质的周期性递变是核外电子排布周期性变化的必然结果。 |
4.元素周期表与原子结构的关系
周期序数= 电子层数
主族序数= 最外层电子=元素的最高化合价数
主族元素的负化合价的绝对值= 8 – 主族序数
3.元素周期表的结构
 3个短周期(1、2、3周期)
3个短周期(1、2、3周期)
周期(7个) 3个长周期(4、5、6周期)
1个不完全周期(7周期)
同周期元素性质递变规律:从左到右(稀有气体除外),元素的金属性逐渐减弱,非金属性逐渐增强。
 主族(7个)IA-VIIA
主族(7个)IA-VIIA
|
VIII族(1个)表中8、9、10三个纵行
零族(1个)表中最右列(稀有气体族)
同主族元素性质递变规律:从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。
2.以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA和ⅡA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
1.掌握元素周期律的实质及元素周期表(长式)的结构(周期、族)。
30(6分)某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mol恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;
(3)把X的单质放入水中,有何现象?写出反应的化学方程式.
29、(12分)有A、B、C、D、E五种主族元素,A的原子核内没有中子;B、C元素处于同一周期,C的原子半径较小,它们的质子数之和为27,质子数之差为5;0.9克D的单质跟足量盐酸反应,生成D3+和1.12L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同的电子层结构。
(1)写出元素符号:A 、B 、C 、D 、E ;
(2)D的最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式 ;
28、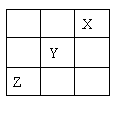 (10分)短周期元素X、Y、Z在元素周期表中的位置关系如右图.(1)X元素单质化学式为
,若X核内质子数与中子数相等,则X单质 的摩尔质量为
;
(10分)短周期元素X、Y、Z在元素周期表中的位置关系如右图.(1)X元素单质化学式为
,若X核内质子数与中子数相等,则X单质 的摩尔质量为
;
(2) Y元素原子的电子式为 ,其单质与水反应的化学方程式为 。
(3)Z元素能与钠形成Na2Z2的化合物,其电子式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com