
题目列表(包括答案和解析)
0.02x 0.04xmol
MnO2+4HCl MnCl2+ Cl2↑+2H2O
MnCl2+ Cl2↑+2H2O
0.04(1-x)mol 0.1(1-x)mol
K2MnO4+8HCl MnCl2+2KCl+2Cl2↑+4H2O
MnCl2+2KCl+2Cl2↑+4H2O
0.04xmol 0.02xmol 0.02xmol 0.02xmol
2KMnO4+16HCl = 2KCl+2MnCl2+ 5Cl2↑ +8H2O
6.1克KCl的量为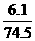 =0.082mol,
=0.082mol,
故原KBr的量应为2×(0.082-0.015)=0.134mol,
原KBr的质量为0.134×199=20g.
(3)生成0.082molKCl需Cl2的量为0.014mol,
故反应消耗Cl2的体积为0.014×22.4=0.92L.
[命题趋势分析]
本节高考要求是要学会运用物质的量运用于化学方程式的计算.
[典型热点考题]
例1 完全中和相同体积,相同物质的量浓度的氢氧化钠溶液,并使之生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸的体积比是( )
A.6∶3∶2 B.6∶2∶3 C.3∶2∶1 D.1∶2∶3
解析 此类无数据题目有两种处理方法,一种列举法是把已知条件转化成简单直观的数据;另一种是用相同的化学符号表达已知数据.此题NaOH溶液实为n(NaOH)相同,再设HCl(aq)、H2SO4(aq)、H3PO4(aq)的体积分别为V1、V2、V3,其物质的量浓度为c,则:
NaOH + HCl = NaCl+H2O
1 ∶ 1
n c·V1
V1=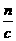
2NaOH + H2SO4 = Na2SO4+2H2O
2 ∶ 1
n c·V2
V2=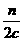
3NaOH+H3PO4 = Na3PO4+3H2O
3 ∶ 1
n c·V3
V3=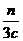
则V1∶V2∶V3=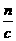 ∶
∶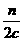 ∶
∶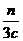
=6∶3∶2
∴本题正确选项为(A)
答案 A
例2 往50.00mL溴化亚铁溶液中缓慢通入1120mL氯气(标准状况),溶液中还原性离子只有2/3溴离子未被氧化.求原溴化亚铁溶液的物质的量浓度.
解析 本题应用物质的量对离子方程式进行计算.
根据反应:Br2+2Fe2+ = 2Fe3++2Br-可判断离子的还原性:Fe2+>Br-,依题意,Br-部分被氧化,则Fe2+全部被氧化.
设原溶液中FeBr2的物质的量为x,则Fe2+物质的量为x,Br物质的量为2x,被氧化的Br-的物质的量为2x/3.
2Fe2++ Cl2 = 2Fe3++2Cl-
x x/2
2Br-+Cl2 = Br2+2Cl-
2x/3 x/3
氯气的物质的量: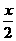 +
+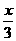 =
=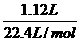 ,
,
解得:x=0.06mol.c(FeBr2)=0.06mol/0.05L=1.2mol/L.
答案 原溴化亚铁溶液的物质的量浓度为1.2mol/L.
例3 已知Cl2在70℃的NaOH水溶液中能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为4∶1.现在49.7gCl2,将其通入足量70℃的NaOH水溶液,反应完全后得到500mL溶液.
(1)写出Cl2在70℃的NaOH水溶液中符合上述条件的总反应方程式.
(2)计算完全反应后各生成物的物质的量浓度(除H2O处).
解析 解答此题的关键是第(1)问.可根据得失电子数相等确定生成物NaCl、NaClO、NaClO3的物质的量之比,进而确定化学方程式中化学计算数.
(1)依题意可设生成NaClO的物质的量为4mol,NaClO3的物质的量为1mol,设生成NaCl的物质的量x,根据得失电子的物质的量相等,有:
1×x=1×4mol+5×1mol,解得:x=9mol.
NaCl、NaClO、NaClO3化学计量数之比与生成对应物质的物质的量相等,即等于9∶4∶1.据此可写出总的化学字方程式:
7Cl2+14NaOH = 9NaCl+4NaClO+NaClO3+7H2O
(2)n(Cl2)=49.7g/71g/mol=0.7mol,由化学方程式可求得n(NaCl)=0.9mol,n(NaClO)=0.4mol n(NaClO3)=0.1mol,
故可求得三种物质的量浓度分别为:
c(NaCl)=1.8mol/L;c(NaClO)=0.8mol/L;c(NaClO3)=0.2mol/L.
答案 (1)7Cl2+14NaOH = 9NaCl+4NaClO+NaClO3+7H2O
(2)C(NaCl)=1.8mol/L,Cl(NaClO)=0.8mol/L,C(NaClO3)=0.2mol/L
例4 甲、乙两位学生用加热氯酸钾的方法制取氧气.甲取了一定质量的氯酸钾和0.10g二氧化锰,经混合后装入试管中加热,待收集到所需氧气时停止加热.试管冷却后,乙称得甲留下的反应混合物的质量为4.04g,将它继续加热,直至氯酸钾全部分解,得到氧气672mL(标准状况).求甲实验时氯酸钾分解的百分率.
解析 设乙分解KClO3的质量为x,甲分解KClO3的质量为y.
2KCl3 2KCl+3O2?
2KCl+3O2?
2mol×122.5g/mol 2mol×74.5g/mol 3mol×22.4L/mol
x 0.672L
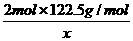 =
=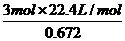 ,解得:x=2.45g.
,解得:x=2.45g.
在4.04g混合物中:m(KCl)=4.04g-0.10g-2.45g=1.49g.
即甲分解KClO3时得到的KCl质量为1.49g,由此可计算y:
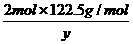 =
=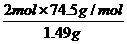 ,解得:y=2.45g.
,解得:y=2.45g.
故甲实验时KClO3分解的百分率为: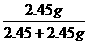 ×100%=50%
×100%=50%
答案 甲实验时氯酸钾分解的百分率为50%.
例5 将0.04molKMnO4固体加热一段时间后,收集到amol气体,此时KMnO4的分解率为x.在反应后的残留固体中加入足量的浓盐酸,又收集到bmol气体(设Mn元素全部以Mn2+存在于溶液中).试填写:
(1)a+b= (用x表示).
(2)当x= 时,a+b取最小值,且最小值为 .
(3)当a+b=0.09时,加热后取得残留固体的质量为 g.
解析 解题的关键是正确写出有关化学方程式,并结合数学知识,解决化学问题.
(1)参加分解的反应的KMnO4物质的量为0.04xmol,剩余的KMnO4物质的量为0.04(1-x)mol,根据化学方程式计算.
2KMnO4 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
0.05molKI与Cl2反应生成0.015molKCl,
0.672L
知在4.04g混合物中m(KCl)=4.04g-0.10g-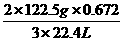 =1.49g即甲分解时得到KCl的质量为1.49g,由此可算出甲实验时KClO3的分解质量:
=1.49g即甲分解时得到KCl的质量为1.49g,由此可算出甲实验时KClO3的分解质量: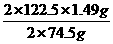 =2.45g
=2.45g
故甲实验时KClO3的分解率为
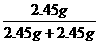 ×100%=50%
×100%=50%
答:甲实验时氯酸钾的分解率为50%
例2 取50mLNa2CO3和Na2SO4的混合溶液.加入过量BaCl2溶液后得到14.51g白色沉淀.用过量的稀HNO3处理后沉淀减少到4.66g.并有气体CO2放出,试计算(1)原混合溶液中Na2CO3、Na2SO4的物质的量浓度
(2)产生标况下气体的体积.
分析 物质的量和组成物质的微粒间存在着一定的关系利用这种关系会使解题简化我们把这种方法称为“守恒法”它用得很广.
据(1)Na2SO4- BaSO4 4.66g不溶于HNO3的沉淀为BaSO4
1mol 233g
n(Na2SO4) 4.66g n(Na2SO4)=0.02mol
故 C(Na2SO4)=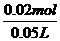 =0.4mol·L-1
=0.4mol·L-1
(2)Na2CO3 -BaCO3 -CO2
1mol 197g 22.4L
n(Na2CO3) (14.51-4.66)g V(CO2)
n(Na2CO3)=0.05mol V(CO2)=1.12L
C(Na2CO3)=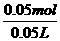 =1mol/L
=1mol/L
答:原混合物中Na2CO3、Na2SO4的物质的量浓度为1mol/L和0.4mol·L-1产生的CO2气体在标况下的体积为1.12L.
[课本难题解答]
P83 三、3 2KBr+Cl2=2KCl+Br2 2KI+Cl2=2KCl+I2
(1)固体残留物中含KCl.
(2)原溶液中n(KI)=36×10-3×0.86=0.031mol,
参加反应的KI有n(KI)=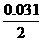 =0.015mol.
=0.015mol.
3.根据不足量求解.
例 用agH2和bgCl2化合制HCl气体,求所得产物的质量.
解析 根据化学方程式列出关系
H2 + Cl2 = 2HCl
2 71
a b
有下列三种情况:
①若71a>2b,则H2过量,应根据Cl2量求HCl的量;
②若2b>71a,则Cl2过量,应根据H2的量求HCl的量;
③若71a=2b,则二者恰好反应完,根据H2或Cl2的量求产物HCl的量.
[难解巧解点拨]
例1 甲、乙两位学生用加热氯酸钾的方法制取O2,甲取一定量的KClO3和0.10gMnO2.经混合后装入试管加热.待收集到所需O2时停止加热.试管冷却后乙称的甲留下的反应混合物的质量为4.04g将它继续加热直到KClO3全部分解完全得到O2672mL(标况).求甲实验时KClO3的分解率.
分析 思路;要求出两个值:一个是总的KClO3质量,一个是甲实验得到的KCl质量而求得甲实验时KClO3分解的质量
做题过程:从后面的结论往前推.
据: 2KClO3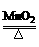 2KCl + 3O2↑
2KCl + 3O2↑
2×122.5g 2×74.5g 3×22.4L
2.判断哪种物质过量.
1.写出化学反应方程式.
2.应注意的问题
(1)化学方程式所表示的是纯净物之间的关系,因此不纯物质必须换算成纯净物的量再进行计算.
(2)在所列比例式中,同一物质上下单位要一致,不同物质左右要对应.
(3)化学计算方法很多,其中守恒法、差量法、平均原子量法等在高一应掌握.
过量问题的计算
一般说来,反应物之间完全反应时,不足量的物质会全部反应转化为生成物,而过量的物质则要剩余.因此判断哪种物质过量,便是解这类题的关键.具体步骤为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com