
题目列表(包括答案和解析)
2.无土栽培技术研究需配制一种营养液.1L此营养液应含0.5molNH4Cl、0.16molKCl和0.24molK2SO4.若用KCl、NH4Cl和(NH4)2SO4三种固体物质来配制,则每升溶液需三种固体的物质的量依次是( )
A.0.32mol、0.5mol、0.12mol B.0.02mol、0.64mol、0.24mol
C.0.64mol、0.02mol、0.24mol D.0.16mol、0.5mol、0.24mol
答案 C
[知识验证实验]
如果一个化学过程中涉及到发生了两个以上化学反应,并且这几个化学反应之间存在一定的内在联系(如第一个反应的生成物作为第二个反应中的反应物,依次下去),则同学们可以找出反应起始物质和终了物质之间的物质的量关系,即关系式,通过关系式进行一步计算.
例 工业上常用漂白粉跟酸反应得出的氯气对漂白粉的质量分数(X%)来表示漂白粉的优劣.漂白粉与酸的反应为:
Ca(ClO)2+CaCl2+2H2SO4 = 2CaSO4+2Cl2↑+2H2O
现为测定一瓶漂白粉的x%,进行如下实验:称取漂白粉样品2.00g,加水研磨后转入250mL容量瓶内,用水稀释至得漂刻度.摇匀后,取出25.0mL,加入过量的KI溶液和过量的稀硫酸,静置.待漂白粉放出的氯气与KI完全反应后,加入0.100mol/l的Na2S2O3溶液20.00mL,恰好与生成的碘完全反应:
2Na2S2O3+I2 = Na2S4O6+2NaI
试由上述数据计算该漂白粉的x%.
解析 要计算该漂白粉的x%.
须求出漂白粉与酸作用产生的氯气的质量
由题可知,发生了三个反应
Ca(ClO)2+CaCl2+2H2SO4 = 2CaSO4+2Cl2↑+2H2O
Cl2+2KI = 2KCl+I2
2Na2S2O3+I2 = Na2S4O6+2NaI
则有关系式:Cl2-2Na2S2O3
71g 2mol
y 0.100mol/L×0.02L y=0.071(g)
故2.00g漂白粉样品产生氯气0.071×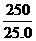 =0.71(g)
=0.71(g)
所以x%=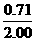 ×100%=35.5%
×100%=35.5%
答案 X%=35.5%
[知识探究学习]
同学们可以每两个同学组成一个小组,分成若干小组,以“物质的量”的自述为题开一次“自我介绍会”,从物质的量的定义、如何理解物质的量这个基本物理量、物质的量的几种计算方法开展一次活动课.
本章实验总结
1.输送氯气的管道为检验其是否漏气,常用浓氨水来检验,试简述其依据的原理.
解析 该过程发生的反应为:
3Cl2+2NH3 = N2+6HCl
HCl+NH3 = NH4Cl
现象及结论 看到白烟,说明有氯气泄漏.
14.现有2mol/L的盐酸和硫酸溶液各100mL,分别加入等质量的铁,反应后生成的气体在标准状况下的体积比为2∶3,求加入盐酸中的铁的质量.
[生活实际运用]
13.Na2O2与H2O反应,如果反应中有1mol电子发生转移,则生成O2的物质的量是多少?若所得溶液为1L,求溶液的物质的量浓度.
12.将4.6g金属钠在空气中小心加热,使其燃烧,得到7g燃烧产物.
(1)求燃烧产物中Na2O和Na2O2的物质的量之比.
(2)将燃烧产物全部溶解在18.8g水中,则所得溶液中溶质的质量分数.
11.将1.95gNa2SO4和Na2CO3的混合物溶于水得到溶液A,在A中加入足量的一定浓度的BaCl2溶液10.0mL,然后过滤得沉淀B和滤液C.在C中加足量AgNO3溶液,又生成5.74g沉淀.向B中加入足量稀硫酸,沉淀增加0.18g.计算:
(1)氯化钡溶液的物质的量浓度;
(2)原混合物中硫酸钠的质量分数.
10.12.3gLiNO3·XH2O转变为LiNO3·(X-2)H2O时质量减少3.6g,则X值是( )
A.3 B.4 C.5 D.6
9.将由CaCO3、MgCO3组成的混合物充分加热至质量不再减小时,称得残留物的质量是原混合物的一半,则残留物中Ca、Mg两元素原子的物质的量之比是( )
A.1∶1 B.1∶2 C.1∶3 D.2∶1
8.在3Cl2+6KOH KClO3+5KCl+3H2O的反应中,得电子和失电子的原子个数比为( )
KClO3+5KCl+3H2O的反应中,得电子和失电子的原子个数比为( )
A.5∶1 B.4∶1 C.3∶1 D.2∶1
7.下列离子方程式书写不正确的是( )
A.碘化钾溶液中滴入氯水 2I-+Cl2= 2Cl-+I2
B.氯气和水的反应Cl2+H2O= H++Cl-+HClO
C.漂白粉溶液中通入适量的二氧化碳ClO-+CO2+H2O= CO2-3+HClO
D.氯水中滴入硝酸银溶液Cl2+Ag+= 2AgCl↓
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com