
题目列表(包括答案和解析)
5.下列反应属氧化还原反应但水既不是氧化剂,又不是还原剂的是( )
A.2Na2O2+2H2O = 4NaOH+O2 B.2Na+2H2O = 2NaOH+H2
C.2F2+2H2O = 4HF+O2 D.Cl2+H2O = HCl+HClO
4.下列关于卤族元素,由上到下性质递变的叙述,正确的是( )
①单质的氧化性 ②单质的颜色加深 ③气态氢化物的稳定性减弱
④单质的沸点升高 ⑤离子半径增大
A.①②③ B.②③④ C.②③⑤ D.①③⑤
3.欲将食盐固体与碘的混合物分开,最好的方法是( )
A.溶解、过滤 B.溶解、过滤、蒸发
C.溶解、加AgNO3,过滤 D.加热升华
2.下列变化规律错误的是( )
A.微粒半径:F-<Cl-<Br-<I- B.稳定性:HI>HBr>HCl>HF
C.还原性:F-<Cl-<Br-<I- D.氧化性:F2<Cl2<Br2<I2
1.卤素单质的性质与F2>Cl2>Br2>I2的变化规律不符合的是( )
A.与H2反应的难易程度 B.非金属的活泼性
C.单质的氧化性 D.熔、沸点
3、萃取和分液的实验操作和原理
(1)原理:利用溶质在两种互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从另一种溶剂中提取出来
(2)操作:①混合振荡 ②静置 ③分液
(3)注意 ①萃取剂应具备的条件 a.萃取剂和原溶剂互不相溶
b.萃取剂和原溶质不发生反应
c.溶质在萃取剂中的溶解度要远大于在原溶剂中的溶解度.
②萃取常在分液漏斗中进行,分液是萃取操作中的一个步骤.
③分液时,打开分液漏斗活塞,将下层液体从下口流出,与下层液体刚好放完时立即关闭活塞,上层液体从分液漏斗上口倒出.
[难题巧解点拨]
例1 把含有某一种氯化物杂质的氯化镁粉末95mg溶于水后,与足量的硝酸银溶液反应,生成氯化银沉淀300mg,则该氯化镁中的杂质可能是( )
A.NaCl B.AlCl3 C.KCl D.CaCl2
分析 极值分析法 假设95mg粉末全部是氯化镁,将它溶于水后与足量AgNO3溶液反应得143.5×2=287mgAgCl沉淀,而现得300mg沉淀,说明氯化镁中的杂质含氯量比MgCl2中含氯量高,可能是2NaCl、2/3AlCl3、2KCl、CaCl2中化学式式量小于MgCl2式量的物质,故选(B).
例2 现有AgCl和AgBr的混合物1.85g,若将此混合物中的AgBr全部转化为AgCl,质量会减少0.2g.求混合物中AgBr和AgCl各是多少g?
解:差量法
AgBr-AgCl 质量差
188 143.5 143.5-188=44.5
m(AgBr) 0.2g
m(AgBr)=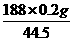 =0.85(g),故m(AgCl)=1.85-0.85=1(g).答:(略)
=0.85(g),故m(AgCl)=1.85-0.85=1(g).答:(略)
例3 砹(At)是原子序数最大的卤族元素,推测砹及其化合物最不可能有的性质是( )
A.At很稳定 B.砹易溶于有机溶剂
C.AgAt不溶于水 D.砹是有色固体
分析 用族元素性质上的相似和递变规律来进行预测①溶解性相似性;②HX的稳定性递变律;③AgX溶解性递变律;④单质颜色的递变律,很容易推出答案为A.
[课本难题解答]
P29 五(1)c(HNO3)=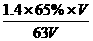 =0.014mol/L
(2)V=
=0.014mol/L
(2)V=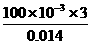 =2.14L
=2.14L
[典型热点考题]
例1 下列试剂保存方法不正确的是( )
A.AgNO3溶液保存在棕色细口瓶中
B.氢氟酸保存在特制塑料瓶中
C.澄清石灰水保存在带胶塞的无色细口瓶中
D.AgBr保存在无色试剂瓶中
解析 A、B、C保存试剂的方法都是正确的,故它们为无效选项,而D项AgBr应保存在棕色试剂瓶中.液体试剂保存在细口瓶中,固体试剂保存在广口瓶中.
答案 D
例2 用溴水作试剂可以将下列各组中的溶液鉴别出来的是( )
A.水、汽油、酒精 B.AgNO3、NaOH、KI
C.NaCl、NaBr、NaI D.汽油、酒精、NaOH
解析 该题涉及某些物质的物理性质和化学性质.汽油能夺取溴水中的溴而汽油与水不互溶,得到分层现象,且上层橙色,下层几乎无色,酒精、水均与溴水互溶,得到的溶液显橙黄色,NaOH与Br2反应使溶液为无色.在A、D两个选项中,A不能区别,D组能用溴水区别,B组有三个反应出现三个不同的现象,即浅黄色沉淀;溴水褪色;溶液显褐色.故B组能区别,C组前两种无反应,现象相同,故不能区别,答案为B、D.
答案 BD
例3 溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,跟水反应的化学方程式为:IBr+H2O=HBr+HIO,则下列关于IBr的叙述中,不正确的是( )
A.固态溴化碘是分子晶体 B.和NaOH溶液反应生成NaBr和NaIO
C.IBr分子中存在极性共价键 D.与水反应,IBr既是氧化剂又是还原剂
解析 解答该题时必须抓住题给信息:IBr的化学性质与卤素单质相似及IBr与水反应的方程式.要认识到IBr是卤素共价化合物,不是单质,不能运用卤素单质性质的思维定势去解题.
IBr和卤素单质一样是由共价键形成的分子,其晶体应是分子晶体.由题给反应方程式可知,IBr与NaOH溶液作用的产物应是NaBr和NaIO.因为元素的非金属性Br>I,所以IBr分子中原子间的共用电子对偏向Br原子,该共价键有极性,分子中碘原子显+1价,溴原子显-1价,跟水反应后产物中溴、碘化合价一致,所以IBr与水的反应不属于氧化还原反应.
答案 D.
例4 如右图装置中,烧瓶中充满了干燥气体a,将滴管中的液体b挤入烧瓶中,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是:( )

|
|
a(干燥气体) |
b(液体) |
|
(A) |
NO2 |
水 |
|
(B) |
CO2 |
4mol·L-1NaOH溶液 |
|
(C) |
Cl2 |
饱和NaCl溶液 |
|
(D) |
NH3 |
1mol·L-1盐酸 |
解析 (A)不是正确答案,NO2虽易溶于水,但它同时还生成气体NO:
3NO2+HO2 = 2HNO3+NO
即使会使烧杯内的水有部分进入烧瓶中也不能几乎充满烧瓶.
选项(B)是正确答案,因为NaOH溶液可以大量地吸收CO2.
2NaOH+CO2 = Na2CO3+H2O
当CO2过量时,甚至生成NaHCO3
Na2CO3+CO2+H2O = 2NaHCO3
上述两种溶液都易溶于水,因而造成烧瓶内压强大大降低,也可以形成喷泉.选项(C)不是正确答案,联想实验室中收集Cl2用排饱和食盐水法可知:饱和NaCl溶液不能吸收Cl2.
选项(D)是正确答案,盐酸很易与NH3发生反应生成溶于水的NH4Cl
NH3+HCl = NH4Cl
因而可使烧瓶内压强急剧降低,形成喷泉.
答案 B、D
例5 市售的碘常含有杂质氯、溴、水.如何除去这些杂质?(要求:①写出加入试剂的名称;②除杂质方法中如属化学变化的要用化学方程式表示;③除杂质方法如属物理变化的要简要叙述除杂质的过程.)
解析 物质的提纯,是利用被提纯物质与杂质的性质不同选择适当的实验手段将杂质除去.除杂质时要求在操作中不能再引入新杂质.在除去杂质时要正确选择试剂,所选的试剂一般只能与杂质反应,而不与被提纯物质反应.
本题属提纯问题,可采用转化分离提纯法.先加入KI,Cl2和Br2转化为KCl、KBr.用吸水剂CaO吸水,再利用碘易升华的性质,通过升华法将碘与固体分离.
①碘化钾、生石灰;
②Cl2+2KI = 2KCl+I2,
Br2+2KI = 2KBr+I2
CaO+H2O = Ca(OH)2
③混合物放在烧杯里,烧杯用一个盛有冷水的烧瓶盖上.加热时碘发生升华,蒸气遇冷凝结在烧瓶底部外侧而与杂质分离.

[同步达纲练习]
2、卤化氢的制备
由于HBr、HI都有较强的还原性,都能被浓硫酸和硝酸氧化,因此,HF、HCl可用浓硫酸制取,而HBr、HI用浓磷酸或用1∶1的硫酸制取.
CaF2+H2SO4(浓)  CaSO4+2HF↑ (在铅皿中)
CaSO4+2HF↑ (在铅皿中)
NaBr+H3PO4(浓)  NaH2PO4+HBr↑
NaH2PO4+HBr↑
KI+H3PO4(浓)  KH2PO4+HI↑
KH2PO4+HI↑
1.卤族元素性质的特殊性
(1)氟元素:①CaF2不溶于水、AgF溶于水
②HF为弱酸,其它氢卤酸为强酸
③F-不能被氧化剂氧化,其它卤离子均能被氧化
④HF能腐蚀玻璃,其它氢卤酸不能腐蚀玻璃
⑤氟无正价,无含氧酸,其它卤素都有正价,有含氧酸.
⑥F2与水反应生成HF和O2,其它卤素有单质的水溶液
(2)溴元素:Br2为绿红棕色液体,很易挥发,冰封保存
(3)碘元素:
①I2遇淀粉溶液呈蓝色(用于鉴定I2的存在)
②I2受热升华
③I2+Fe=FeI2(I2氧化性弱,盛I2的试剂瓶不能用铁盖)
3.表示方法;在化学方程式里,用两个方向相反的箭头代替等号来表示可逆反应.如H2+I2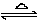 2HI
2HI
[重点难点解析]
2.特点:同一条件,同时进行.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com