
题目列表(包括答案和解析)
26、(6分)现有碳酸钠和碳酸氢钠的混合物13.7g,加热灼烧至固体质量不再减少后,再跟足量的盐酸反应,放出2.24L二氧化碳(标准状况),计算原混合物中碳酸钠和碳酸氢钠各占多少克?
25、(9分)已知A为正盐,已知:(1)常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,H、I为有色气体,I通常为红棕色气体。(2)F在常温下是一种无色液体。(3)C、J、K的水溶液是一种酸。图中反应条件(除加热外)均已略去。
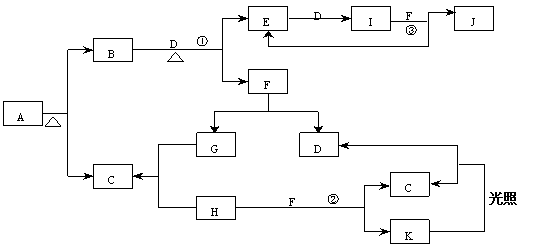 (1)写出A、J、K的化学式A___________,J____________,K_____________。
(1)写出A、J、K的化学式A___________,J____________,K_____________。
(2)写出图中①②③处的化学方程式
①________________________________________________
②________________________________________________
③________________________________________________
24、(10分)下表是元素周期表的主族和零族部分,请用相应的化学用语回答有关问题:
|
主族 周期 |
|
|
ⅢA |
|
|
|
|
0 |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
A |
|
B |
|
|
|
C |
D |
|
|
|
E |
|
|
|
|
F |
|
|
|
G |
|
H |
|
|
5 |
|
|
|
|
|
|
|
J |
⑴A、B的气态氢化物的稳定性是 > 。(用相应化学符号填写,下同)
⑵A、B、C、D的离子半径由大到小的顺序是 。
⑶若E的原子序数为m,则A的原子序数是 ,H的原子序数是 。
⑷C、D、F的最高价氧化物的水化物的碱性强弱顺序是 。
⑸E、G的最高价氧化物的水化物的酸性强弱顺序是 。
⑹C在空气中燃烧产物的电子式是 。
⑺A-J所有元素中,两两相互结合成原子个数比为1∶2的离子化合物的化学式是 。
23、(7分)(1)第ⅣA族某元素的单质是一种良好的半导体材料,该元素的金属性比其非金属性强,则该元素是 ,其最高价氧化物的化学式 。
(2)写出工业上制造普通玻璃的主要反应的化学方程式:
(3)高岭石的组成是(Al2(Si2O5)(OH)4)若用氧化物的形式来表示,可表示为
。
22、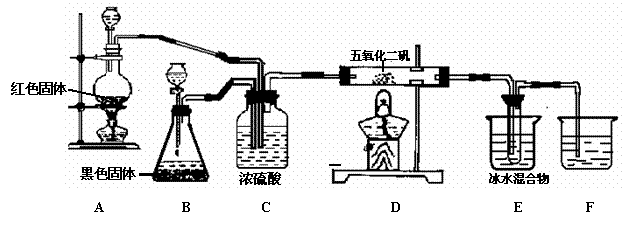 (9分)实验室合成SO3的装置如图;试回答
(9分)实验室合成SO3的装置如图;试回答
(1)装置B中的黑色固体是:
(2)装置C的作用:
① ;
② ;
③ 。
(3)A处反应的化学方程式:
D处反应的化学方程式:
(4)E中冰水混合物的作用是
21、(2分)下列说法合理的是
A 在某试样中加入盐酸酸化的氯化钡溶液有白色沉淀生成,可推知试样中肯定存在SO42-。
B 等体积的SO2和Cl2混合后,若通入到品红溶液中,品红溶液会褪色;
若通入到BaCl2溶液中,会产生白色沉淀。
C 用淀粉KI试纸检验NO2时,须先用蒸馏水将试纸湿润。
D 铜粉中加盐酸不反应,加适量KNO3晶体后,溶液变蓝。
20、一定质量的Fe和Cu的混合物,先与适量的稀硝酸反应后,剩余a克固体;再向其中加入少量稀硫酸,充分反应后,还剩余固体b克固体。则下列说法正确的是
A、a一定等于b B、a可能等于b
C、a一定大于b D、a一定大于或等于b
高一化学第二学期期末调研测试
第I卷选择题答案纸
第II卷(非选择题,共50分)
18、下面是实验室制取氨气的装置和选用的试剂,其中错误的是

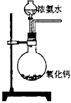


A B C D
|
2KClO3+H2C2O4+H2SO4==2ClO2↑+2K2SO4+2CO2↑+2H2O。下列说法正确的是
A、KClO3在反应中得到电子 B、ClO2是氧化产物
C、H2C2O4在反应中被还原 D、1molKClO3参加反应有2mol电子转移
17、用98%浓H2SO4吸收SO3可以得到焦硫酸(H2SO4·SO3),若用1kg 98%H2SO4充分吸收SO3得到焦硫酸,再进行稀释,可得到98%的H2SO4的质量为
A.1.98kg B.2.00kg C. 2.22kg D.2.42kg
16、N0为阿伏加德罗常数的值,下列叙述正确的是
A 80g硝酸铵含有氮原子数为2N0
B 1L 1mol·L-1的盐酸溶液中,所含氯离子数为N0
C 标准状况下,11.2LSO3所含分子数为0.5 N0
D 在铁与硫的反应中,1mol铁失去的电子数为3 N0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com