
题目列表(包括答案和解析)
5.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EKJ的能量,下列说法正确的是( )
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的金刚石与石墨完全燃烧,金刚石放出的能量多
D.等质量的金刚石与石墨完全燃烧,石墨放出的能量多
4.下列说法正确的是( )
A.需要加热方能发生的反应一定是吸热反应
B.是放热的反应在常温下一定很容易发生
C.是放热反应还是吸热反应主要是由反应物和生成物的总能量的相对大小来决定
D.吸热反应发生过程中要不断从外界获得能量,放热反应自始至终不需要外界能量
3.下列物质加入水中,显著放热的是( )
A.生石灰 B.固体NaOH C. 固体NaCl D.固体硝酸铵
2.已知化学反应2C(S)+O2(g) 2CO(g);2CO(g)+O2(g)
2CO(g);2CO(g)+O2(g) 2CO2(g)都是放热反应。据此推断,下列说法不正确的是(其他条件相同)( )
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(其他条件相同)( )
A.12gC所具有的能量一定高于28gCO所具有的能量
B.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多
1.下列说法正确的是( )
A.物质发生化学变化都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
A |
A |
A |
A |
B |
BC |
D |
D |
D |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
AD |
B |
C |
C |
C |
C |
BD |
C |
A |
D |
21吸收空气中的CO2生成Na2CO3的缘故;取少量试液,加入BaCl2 ;有沉淀生成;适量的石灰水;滴加石灰至不再产生沉淀为止,经过滤即可。
22
(1)⑤、③、④、⑥、⑦、②、①、⑧(⑥、⑦可对换)。
(2)大理石;盐酸。
(3)除去混在O2 中未反应的CO2;吸收C02中混有的HCl.
(4)a;c。
23(1)A.Na;B.Na2O ;C. Na2O2 ;D.H20;E.NaOH;F.H2;G.02
(2)①A→B:4Na+02=2Na2O ②A→E:2Na+2H20=2NaOH+H2↑③C+E:2Na202+2H20=4NaOH+02↑24.(1)见下图。
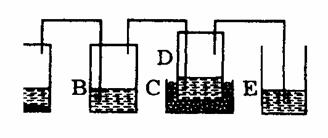
(2)A:CaC03,并由漏斗加入 6mol/L HCl;B:蒸馏水;C:冰水;D:氨化的饱和NaCl 溶液;E:6moL/LH2S04 (3)取少量产品放在试管中,在酒精灯上加热至不再有气体放出时,停止加热。试管中如有白色剩余物质,则得到的产品不是碳酸氢铵。试管冷却后,向其中加入适量盐酸,反应激烈,冒大量气泡,最后剩余物全部溶解,说明得到的结晶是碳酸氢钠;如果加入盐酸后,晶体全部溶解,但没有气泡产生,则得到的结晶可能是食盐。
25 (1)8.4g 12.5g (2)8
26 2CO2+2Na2O2=2Na2CO3 +O2↑
2H2O +2Na2O2 =4NaOH+O2 ↑
补充适量的水蒸气
25.在25℃时向100ml含HCl 14.6g的盐酸溶液里放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末收集到H21.12L(标况),在此之后又经过4min,铁粉完全溶解 ,则
① 在前2min内用FeCl2表示的平均反应速率是多少?
② 在后4min内用HCl表示的平均反应速率是多少?
③ 在前2min与后4min相比,反应速率哪个较快?为什么?
24. 已知实验室制取H2S气体的原理是:FeS+H2SO? FeSO4+H2S.根据
下图中A-D的实验装置和试剂进行实验,回答下列问题:
已知实验室制取H2S气体的原理是:FeS+H2SO? FeSO4+H2S.根据
下图中A-D的实验装置和试剂进行实验,回答下列问题:
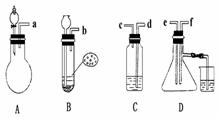 (1)装置A是由双孔塞、玻璃导管及
和
组装起来的.
(1)装置A是由双孔塞、玻璃导管及
和
组装起来的.
(2)组装一套制取SO2气体的装置,并证明SO2既有氧化性,又有还原性.
①按实验装置连接顺序,把a f各导管口连接起来,正确的顺序是 ,连 , 连 ;
f各导管口连接起来,正确的顺序是 ,连 , 连 ;
②C装置中的溶液是 ,反应后该溶液变为无色,说明SO2具有 性;
③D中产生的现象是 ,说明SO2具有 性;
(3)A装置中发生反应的化学方程式为 .
(4)烧杯中NaOH溶液的作用 .
23. 工业上将硫磺混入Na2SO3溶液中共热至沸可制取Na2S2O3;Na2SO3+S Na2S2O3.制备硫代硫酸钠的另一种方法是:把SO2通入Na2S和Na2CO3的混合溶液中,在反应过程中,先生成黄色沉淀,其量逐渐增多,然后又逐渐减少,当
形成无色透明溶液时,反应完成.
工业上将硫磺混入Na2SO3溶液中共热至沸可制取Na2S2O3;Na2SO3+S Na2S2O3.制备硫代硫酸钠的另一种方法是:把SO2通入Na2S和Na2CO3的混合溶液中,在反应过程中,先生成黄色沉淀,其量逐渐增多,然后又逐渐减少,当
形成无色透明溶液时,反应完成.
(1)写出用上述反应制备Na2S2O3的化学方程式:① ,② ,
 ③
,④Na2SO3+S Na2S2O3;
③
,④Na2SO3+S Na2S2O3;
(2)原料中Na2CO3、Na2S和SO2的物质的量之比最好是 ;
(3)若SO2过量,则又会有浅黄色沉淀出现,其原因是(用化学方程式表示) .
22.固体A、B都由两种相同元素组成,A、B中两种元素的原子个数比为1∶1和1∶2.将A、B高温煅烧,产物都是固体C和气体D,由D最终可制得强酸E,E的浓溶液和铜片在加热条件下反应生成气体D.E的稀溶液和A反应时,生成气体G和溶液F,G通入D的水溶液中,有浅黄色沉 淀生成.在F中滴入溴水后,加入KOH溶液有红褐色的沉淀生成,该沉淀加热时能转变为C,根据上述事实回答:
(1)A、B的化学式分别为 , .
(2)写出下列反应的化学方程式:
①A煅烧生成C和D ;
②B煅烧生成C和D ;
③G通入D的溶液中 ;
④在F中滴入溴水 ;
(3)写出A和E反应的离子方程式 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com