
题目列表(包括答案和解析)
3.氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是( )
A.单质的密度依次增大 B.单质的熔、沸点依次升高
C.Cl2可从KBr溶液中还原出Br2 D.F2可从NaCl溶液中还原出Cl2
2.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.x+2 B.x+4 C.x+8 D.x+18
1.下列关于原子的几种描述中,不正确的是( )
A.18O与19F具有相同的中子数 B.16O与17O具有相同的电子数
C.12C与13C具有相同的质量数 D.15N与14N具有相同的质子数
28.(6分)有一亚硫酸钠,可能已经变质。现将亚硫酸钠试样烘干后,称取a克,用蒸馏水溶解,加足量硝酸钡溶液,滤出生成的沉淀,洗净、干燥,得沉淀b克,试写出下列三种情况b与a的关系式: (1)当亚硫酸钠没有变质时:_____________
(2)当亚硫酸钠部分变质时:_____________ (3)当亚硫酸钠完全变质时:_____________
27.(5分)在氧气中燃烧0.4克硫和铁组成的化合物样品,使其中硫全部转化为SO2,又全部转化为硫酸,这些硫酸可以跟20毫升0.5摩/升的NaOH溶液完全中和,原化合物中硫的百分含量是多少?
26.(4分) 下图是超导化合物----钙钛矿晶体中最小重复单元(晶胞)的结构。请回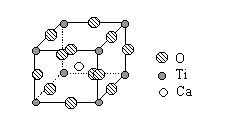 答:
答:
(1)该化合物的化学式为 。
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有 个。
24.(5分) 某亚硫酸钠试剂已部分被氧化,为确定其纯度要进行如下实验:①称取样品m1 g;②将样品溶解;③给溶液加入稍过量盐酸酸化的BaCl2溶液;④过滤、洗涤、干燥沉淀,称得其质量为m2 g。回答: (1)BaCl2要用盐酸酸化的原因 。 (2)BaCl2溶液稍过量的目的 。 (3)判断(2)是否完成的方法是 。 (4)判断沉淀是否洗净的方法是 。 (5)Na2SO3纯度表示式为W(Na2SO3) 。
25(10分)有A、B、C、D 4种元素,它们的原子序数由A到D逐渐增大。①D的氧化物分子式为DO2,D的最高价氧化物中,D的质量百分含量为40%,而且D的原子核中,质子数和中子数相等,②A和B原子有相同的电子层数,A原子的最外层电子数是次外层电子数的2倍;⑧B的阴离子与C的阳离子和Ne原子的电子层结构相同。通常状况下,B的单质是气体,0.1摩B和H2完全反应时,有2.408x1023个电子转移,C的单质在高温下与B的单质充分反应,可生成浅黄色固体,此生成物与AB2反应可生成B的单质。根据以上叙述试回答:
(1)指出四种元素的名称:A_____,B_____,C_______,D______。
(2) 写出AB2的结构式_________;分子空间构型________,AB2晶体俗名叫________;是________晶体(原子、分子、离子)
(3)电子式表示B、C在高温下化合的过程______________
23.(5分) 为了保护环境,变害为利,工业上常用纯碱吸收有害气体,同时得到NaHSO3,该反应的离子方程式为_____________,从这一个反应可见H2SO3的酸性比H2CO3的酸性________;H2O2可作为脱氯剂使用,该反应的方程式为________________。
22.(8分)在原子序数为 1 - 18 号的元素中, 用适当的化学符号填写下列空白(稀有气体除外):
(1)原子半径最大的是 ______ , 简单离子中, 离子半径最大的是 _____
(2)气态氢化物最稳定的是 _______ , 气态氢化物中含有H 元素质量分数最大的氢化物是________
(3)酸性最强的无氧酸是______, 碱性最强的是_______ ,酸性最强的含氧酸是 _________, 属于两性氢氧化物的物质是___________.
21.(7分)下列物质存放在敞口容器中,总质量有何变化(增大、减小、不变):
金属钠____________,NaOH固体_________, Na2CO3·10H2O__________,
浓硫酸____________,浓盐酸_____________, 石灰水________________,
NaCl溶液_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com