
题目列表(包括答案和解析)
5.设NA为阿伏加德罗常数,下列说法不正确的是
A.2.3g金属钠变成钠离子时失去的电子数目为0.1 NA
B.32g氧气所含原子数目为NA C.17 g氨气所含电子数目为10NA
 D.在标准状况下,0.5 NA个氯气分子所占体积约是11.2L
D.在标准状况下,0.5 NA个氯气分子所占体积约是11.2L
4.下列说法正确的是
A.NaCl固体不导电,NaCl是非电解质
B.CO2的水溶液能导电,所以CO2是电解质
C.铜、石墨均能导电,所以它们都是电解质
D.蔗糖在水溶液或熔化时均不导电,所以它是非电解质
3.造纸厂常用氯气漂白纸浆,漂白后的纸浆用NaHSO3除去残留的氯气,有关反应式为:Cl2 + NaHSO3 + H2O = NaHSO4 + 2HCl 。在这个反应中,氧化产物与还原产物的物质的量之比为
A.2∶3 B.1∶1 C.2∶1 D.1∶2
2.关于化学反应本质的下列叙述中,正确的是
A.在氧化还原反应中,非金属单质既可作氧化剂,又可作还原剂
B.阴离子只能失去电子被氧化,作还原剂
C.失电子越多的还原剂,其还原性越强
D.某元素从化合物变为单质时,该元素一定被还原
1.在①化合反应、②分解反应、③置换反应、④复分解反应四种基本反应类型中,可以生成水的是
A.只有②③ B.只有①④ C.只有 ①②④ D.①②③④
27.
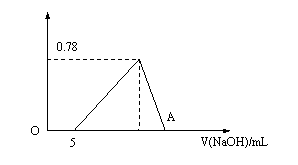 向20mL盐酸和氯化铝的混合溶液中,逐滴加入2mol/L NaOH溶液,生成沉淀的质量与NaOH溶液的体积关系如图所示。
向20mL盐酸和氯化铝的混合溶液中,逐滴加入2mol/L NaOH溶液,生成沉淀的质量与NaOH溶液的体积关系如图所示。
(1)求原溶液中Al3+和Cl-的物质的量浓度分别是多少?
(2)求A点处NaOH溶液的体积为多少mL?
 第一学期期中考试
第一学期期中考试
26.可能由CO、CO2和O2组成的混合气体30mL,通过足量的Na2O2,经充分反应后,气体体积变为25mL,引燃剩余气体,恢复到原温度,测得气体体积变为20mL(气体体积均为相同条件下测得)。试通过计算确定原混合气体中有无O2?体积是多少?
25.实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
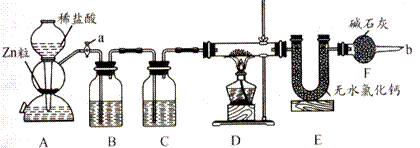
(1)如何检查装置A的气密性。_________________________________________
(2)为了安全,在点燃D处的酒精灯之前,在b处必须_____________________。
(3)装置B 的作用是_______________ ,装置C中装的液体是________________,所起的作用是_______________________。
(4)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生的化学反应方程式是________________________________________。
(5)若FeO和Fe2O3固体混合物的质量为23. 2g,反应完全后,U型管的质量增加7.2g则混合物中Fe2O3的质量为______________。
(6)U型管E右边连接干燥管F的目的是______________________,若无干燥管F,测得Fe2O3的质量将_____________(填“偏大”、“偏小”或“无影响”)
(7)若反应后得到的残留固体中还有少量FeO,测得的Fe2O3质量将__________(填“偏大”、“偏小”或“无影响”)。
24.根据下图所示的转化关系及现象填空(假设每一步反应的反应物均恰好反应完):


(1)反应①中,当有3.2 g气体产生时,消耗淡黄色固体的物质的量是__________;
固体增重__________克
(2)反应②、③、④的离子方程式为:
② _____________________________________________
③_____________________________________________
④_____________________________________________
23.(1)分别取m g Na、Mg、Al与足量的盐酸反应,在相同条件下产生的氢气的体积比是 。
(2)若产生相同体积(同温同压下)的氢气,所需Na、Mg、Al 三种金属的物质的量之比是 。
(3)若将0.2 mol Na 、Mg、Al分别投入20 mL1mol/L的盐酸中,在标准状况下,产生的氢气的体积大小顺序是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com