
题目列表(包括答案和解析)
1.下列反应中一定不属于氧化还原反应的是 ( )
A.复分解反应 B.分解反应
C.置换反应 D.化合反应
27.(11分)(1)Na2O和Na2O2的混合物140g和足量水作用,得到4L溶液,其中含溶质160g。试计算原混合物中Na2O2的质量。
(2)若Na2O和Na2O2的混合物质量为Wg ,和足量水作用后得到的溶液中,所含溶质的质量较原混合物增加了Xg 。试写出X的数值大小范围(以含W的代数式表示之)。
26.(8分)某盐酸的密度为1.05g/cm3,其中HCl的质量分数为10% 。试回答:
(1)该盐酸的物质的量浓度为多少?
(2)200mL该盐酸跟过量的铁粉充分反应,生成H2的体积(标准状况)是多少升?生成的FeCl2的物质的量是多少?
25.(6分)在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下述实验:(1)用pH试纸检验,该溶液呈强酸性;(2)取部分溶液,滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳层呈紫色;(3)另取部分溶液,逐滴加入NaOH溶液,使溶液由酸性逐渐呈碱性,然后再加入Na2CO3溶液,有白色沉淀生成。根据上述实验现象,推断原溶液中肯定存在的离子是 ,肯定不存在的离子是 ,可能存在的离子是 。
24.(6分)在1968年,化学家用刚发现不久的XeF2(二氟化氙)和KBrO3首先制得BrO4-,不久得到纯净KBrO4晶体。
(1)已知XeF2与水反应生成O2和氙气,氟仍以化合态留在水溶液中,则每生成1molO2,转移电子数为 mol;该反应的氧化剂是 。
(2)写出XeF2与含KOH、KBrO3的水溶液反应得到KBrO4的化学方程式:
。
23.(14分)如下图所示,A为银白色金属,C为淡黄色固体,A、B、C、D、E、F中均含有同一种元素。常温下G为液态,H为气态。
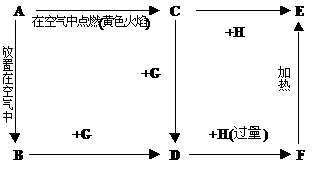
试回答:(1) 写出化学式:C ,D ,F ,
G ,H 。
(2) A与水反应的离子方程式为: 。
(3) 写出F→E的化学方程式: 。
22. (6分)标准状况下8.96L的CH4和CO的混合气体的质量为7.6g,则:
(1)此混合气体的平均摩尔质量为 ;
(2)上述混合气体中CH4的体积为 ;
(3)若将上述混合气体与标准状况下的16.8 L O2混合点燃,完全反应后恢复到原来的温度和压强,则所得气体的相对分子质量为 。
21. (2分) 质量分数相等的Na2CO3和NaHCO3的混合物x g ,加热一段时间后,质量变为y g,当y为何值时,表明NaHCO3已完全分解 (用含x、y的式子表示)
20.(每空2分,共14分)分析下列实验图,回答有关问题

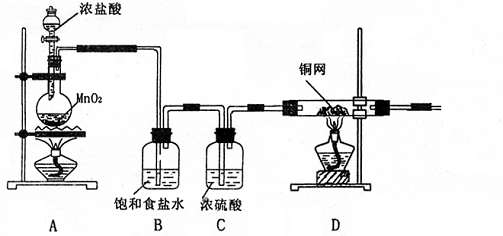
(1)写出A中发生反应的离子方程式 。
(2)上图中B、C两个装置能否调换位置 (填“能”与“不能”),原因是
(3)实验开始时,对于A、D两处的酒精灯,应该先点燃 。
(4)在D中观察到的现象是 。
(5)尾气吸收的溶液为 ,其中发生反应的离子方程式为 。
19.(11分) (1)下列说法正确的是 (3分,答对1个1分,错一个扣1分)
A 氯水应该保存在无色的细口玻璃瓶中
B 少量金属钠应该保存在煤油中
C 分离碘和沙子的混合物可选用升华法
D 液溴应该保存在棕色试剂瓶中,并加少量水,减少其挥发
E 在碘水中加入适量的CCl4,振荡静置后,上层溶液应该为紫红色
(2)(每空2分,共6分)配制一定物质的量浓度为0.2mol/LNaOH溶液500mL,请回答以下问题:
①应称量NaOH的质量 g,
②应选用容量瓶的规格 mL,
③将已称量好的氢氧化钠固体配成溶液,除容量瓶外还需要的其它仪器 。
(3)下列操作对所配制的NaOH溶液浓度有偏高影响的是 (2分,答对1个给1分,错选一个扣1分)。
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.定容时俯视容量瓶中的液体
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.将称量的NaOH固体露置在空气中的时间过长
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com