
题目列表(包括答案和解析)
1、材料可按其化学组成、状态、性质、效应、用途等进行多种分类,下列把材料按化学组成分类,其中不正确的是( )
A、陶瓷属于非金属材料 B、橡胶属于有机高分子材料
C、合金属于非金属材料 D、化纤属于有机高分子材料
26.(8分)氧化铜在高温下发生分解反应,其反应方程式可表示为:4CuO 2Cu2O+O2,现将80
g CuO 进行灼烧,测得固体含铜质量分数为86%,求该CuO的分解百分率为多少?
2Cu2O+O2,现将80
g CuO 进行灼烧,测得固体含铜质量分数为86%,求该CuO的分解百分率为多少?
[解析] 由于反应前后Cu元素的质量不会发生改变,固体减少的原因是产生部分O2,因此利用固体质量前后变化来解比较简便。创设CuO分解x g,则有如下质量关系:
4CuO 2Cu2O+O2 固体减少
2Cu2O+O2 固体减少
4×80 32
x 0.1x
即固体共减少0.1x g,原总Cu元素的质量为:
80×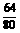 =64(g),根据题意有:
=64(g),根据题意有:
 ×100%=86%
×100%=86%
解得:x=56(g)
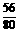 ×100%=70%
×100%=70%
[答案] 70%
25.(6分)在反应8NH3+3Cl2====6NH4Cl+N2反应中,若有56 g N2 生成,求发生氧化反应的物质的质量。
[解析] 该反应是氧化还原反应,发生氧化反应的物质是NH3,在所有参加反应的NH3中,只有四分之一参加氧化还原反应而被氧化,计算可按关系式求解,创设被氧化的NH3为x g,则有如下关系:
2NH3 ~ N2
2×17 28
x 56
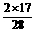 =
=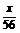 x
=68(g)
x
=68(g)
[答案] 68 g
24.(5分)已知硫酸铅是一种作画的白色颜料,难溶于水,也难溶于稀硝酸,但该物质却可以溶于醋酸铵溶液形成无色溶液,其化学方程式可表示为:
PbSO4+2CH3COONH4====Pb(CH3COO)2+(NH4)2SO4
假如往上述含有Pb(CH3COO)2的溶液中通入H2S气体,则溶液中立即出现黑色沉淀PbS,其化学方程式可表示为:
Pb(CH3COO)2+H2S====PbS↓+CH3COOH
请依据上述反应事实,写出H2S产生沉淀物与PbSO4溶于CH3COONH4溶液中的离子方程式。
[解析] PbSO4固体可溶于CH3COONH4的原因是有难电离的Pb(CH3COO)2生成,因而Pb(CH3COO)2属弱电解质;PbS是难溶物质。离子方程式中Pb(CH3COO)2以分子式表示。
[答案] Pb(CH3COO)2+H2S====PbS↓+2CH3COOH
PbSO4+2CH3COO-====Pb(CH3COO)2+SO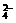
23.(9分)过氧化氢H2O2可用于采矿业废液消毒剂,如消除采矿废液中的氰化物发生如下反应(已配平):KCN+H2O2+H2O====A+NH3↑,请回答:
(1)生成物A的化学式可表示为: ;
(2)该反应是氧化还原反应吗?若是则氧化剂是 ,若不是,则说明理由。
[解析] 根据质量守恒定律,反应前后所参加反应的元素原子总数不变。过氧化氢中的氧呈-1价,在生成物中氧呈-2价,O元素化合价降低。
[答案] (1)KHCO3 (2)是氧化还原反应 H2O2
22.(8分)写出符合下列要求的化学反应方程式,各任写一个。
(1)一种单质氧化另一种单质
(2)一种单质氧化一种化合物
(3)一种化合物氧化一种单质
(4)同一种物质中不同元素之间发生氧化还原反应
[解析] 依据氧化还原反应的概念,联系化学变化中的典型物质,并尽可能将氧化还原反应与四种基本反应类型有机结合起来。
[答案] (1)3Fe+2O2 Fe3O4
Fe3O4
(2)2O2+CO 2CO2
2CO2
(3)CuO+H2 Cu+H2O
Cu+H2O
(4)2KClO3 2KCl+3O2↑
2KCl+3O2↑
21.(9分)有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2SO3中的一种或几种,现做以下实验:
(1)将部分粉末加入水中,振荡,有白色沉淀生成,过滤溶液呈无色;
(2)向(1)的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
(3)取少量(2)的溶液,滴入稀硫酸,有白色沉淀产生;
(4)另取(1)中过滤后的溶液加入足量AgNO3溶液产生白色沉淀。试根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是 ,一定不含的物质是 ,可能含有的物质是 。(以上各种物质均写化学式)
(2)写出各步变化的离子方程式。
[解析] 溶于水后形成的滤液呈无色,说明溶液中没有Cu2+,原粉末中肯定无CuSO4。沉淀物一定是BaCO3,即原溶液中存在Ba2+和CO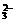 ,说明固体粉末中有Ba(NO3)2和Na2CO3;但依据滤液与AgNO3溶液作用产生白色沉淀,只能判断,可能是AgCl沉淀,也可能是Ag2CO3沉淀。
,说明固体粉末中有Ba(NO3)2和Na2CO3;但依据滤液与AgNO3溶液作用产生白色沉淀,只能判断,可能是AgCl沉淀,也可能是Ag2CO3沉淀。
[答案] (1)Ba(NO3)2、Na2CO3 CuSO4 NaCl
(2)Ba2++CO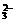 ====BaCO3↓
====BaCO3↓
BaCO3+2H+====Ba2++CO2↑+H2O
SO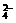 +Ba2+====BaSO4↓
+Ba2+====BaSO4↓
CO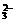 +2Ag+====Ag2CO3↓
+2Ag+====Ag2CO3↓
Ag++Cl-====AgCl↓
20.久盛石灰水的试剂瓶内壁附有一层垢物,除去该垢物应选择下列何种试剂效果较好
A.饱和氯化钠溶液 B.稀硫酸
C.氢氧化钠溶液 D.稀盐酸
[解析] 垢物主要成分是CaCO3固体,盐酸可与CaCO3完全作用生成可溶性盐CaCl2,但CaSO4是微溶物质,会覆盖在CaCO3固体表面,因此要使用稀HCl。
[答案] D
第Ⅱ卷(非选择题 共45分)
19.有某种浓度的盐酸,将一定量的该盐酸分成三等份A、B、C。往A中加入适量蒸馏水稀释,往B中滴加少许AgNO3溶液,过滤后保留原溶液,C保持原样,现以相同浓度的NaOH溶液中和以上三种溶液至中性,消耗NaOH溶液的体积分别为VA、VB、VC,则它们的大小关系正确的是
A.VA=VC>VB B.VA<VB<VC
C.VA>VC>VB D.VA=VB=VC
[解析] 加水稀释后,H+浓度发生变化,但总量不变;加AgNO3溶液Cl-变少,但H+不变。
[答案] D
18.除去下列溶液中的杂质(括号内是杂质),下列选项中所用试剂错误的是
A.NaOH[Ba(OH)2]:使用Na2SO4溶液
B.KOH(K2SO4):使用Ba(OH)2溶液
C.NaCl(Na2SO4):使用Ba(NO3)2溶液
D.HNO3(HCl):使用AgNO3溶液
[解析] 所加试剂中不能引进新的杂质离子。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com