
题目列表(包括答案和解析)
1、( )以NA表示阿伏加德罗常数,下列说法正确的是:
A.1L0.1mol·L-1的醋酸溶液中含离子和分子总数是0.1NA
B.22.4L氖气中所含原子数为NA C.1.6gNH2-离子中所含电子数为NA
D.2gD2O所含中子数为NA
22.A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4。1 molA的单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)A是_________元素,B是___________元素,C是___________元素。
(2)分别写出A、B最高正价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离
子方程式:_____________________________________________________________。
(3)A离子的氧化性比B离子的氧化性 _____________,这是由于_____________。
21.有A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。
B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C原子核内有12
个中子的二价金属,当2.4gC与足量热水反应时,在标准状况下放出2.24LH2。D的M
层上有7个电子。则A、B、C、D各是什么元素。
A_____________B_____________C_____________D_____________
20.有下列四种微粒:① O、②
O、② Na、③
Na、③ Mg、④
Mg、④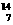 N
N
(1)按原子半径由大到小顺序排列的是__________________________
(2)微粒中质子数小于中子数的是______________________________
(3)在化合物中呈现的化合价的数值最多的是____________________
(4)能形成X2Y2型化合物的是___________,能形成X3Y2型化合物的是___________。
19.元素周期律是指元素的性质随___________的递增,而呈_______性变化的规律,这里元素的性质主要是指_____________和_____________;元素性质周期性变化是__________________________呈周期性变化的必然结果。
18.在Na、K、O、N、C.Li、F、H八种元素中,原子半径由小到大的顺序为_________________________________。
17.在原子序数1-18号元素中:
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)在室温下有颜色的气体单质是_____________。
(4)最高价氧化物对应水化物的酸性最强的元素是_____________。
(5)除稀有气体外,原子半径最大的元素是_____________,它的原子结构示意图是
_____________。
(6)原子半径最小的元素是_____________。
(7)气态氢化物水溶液呈碱性的元素是_____________。
(8)最稳定的气态氢化物化学式是_____________。
16.下列各组物质的性质变化正确的是 ( )
A.酸性HClO4>HNO3>H3PO4>H2SiO4 B.稳定性H2S>HCl>HBr>HI
C.熔点Pb>K>Na>Li D.溶解性NaHCO3>Na2CO3>NaOH
15.下列递变规律不正确的是 ( )
A.Na、Mg、Al还原性依次减弱 B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大 D.P、S、Cl最高正价依次升高
14.Y元素最高正价与负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中 电离出电子层结构相同的离子,该化合物是 ( )
A.KCl B.Na2S C.Na2O D.K2S
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com