
题目列表(包括答案和解析)
实验:分别向H2SO4、Na2SO4、Na2CO3、Na2SO3、Na3PO4五种溶液中先加入BaCl2溶液,再加入稀盐酸,各产生什么现象?写出有关反应的离子方程式。
小结:实验室检验硫酸根离子的操作方法是 。
思考:(1)若向某无色溶液中先加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,可由此判断此溶液中含有SO 吗?为什么?
吗?为什么?
(2)向Na2SO3溶液中先加BaCl2溶液产生白色沉淀,再加稀HNO3沉淀没有溶解;向Na2SO3溶液中先加稀HNO3酸化,再加BaCl2也产生了白色沉淀。
这是为什么?
[例1]向50 mL 18 mol·L-1 H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.小于0.45 mol B.等于0.45 mol
C.在0.45 mol和0.90 mol之间 D.大于0.90 mol
[例2]三位学生设计了下述三个方案,并都认为:如果观察到的现象和自己设计的方案一致,即可确证试液中有SO 。
。
|
|

 试液
白色沉淀
沉淀不溶解
试液
白色沉淀
沉淀不溶解
|
|

 试液
无沉淀
白色沉淀
试液
无沉淀
白色沉淀
|
|

 试液
无沉淀
白色沉淀
试液
无沉淀
白色沉淀
试评价上述各方案是否严密,并分别说明理由。
答:方案甲
方案乙
方案丙
[例3]浓硫酸具有A.强酸性B.强氧化性C.高沸点、低挥发性,D.脱水性,E.吸水性等性质。以下过程主要表现了浓硫酸的哪些性质?请将答案的字母分别填入括号中
(1)用NaCl固体和浓H2SO4在加热条件下制氯化氢气体。( )
(2)用磷矿粉(主要成分Ca3(PO4)2)和硫酸反应制磷酸。( )
(3)热的浓硫酸分别与铜片、木炭和硫粉等反应。( )
(4)浓硫酸干燥H2、O2、Cl2、HCl和SO2等气体。( )
(5)常温下可以用铁或铝的容器贮存浓硫酸。( )
(6)胆矾放在盛浓硫酸的干燥器中变成白色粉末。( )
(7)不能用浓硫酸干燥HBr、HI和H2S等气体。( )
(8)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑。( )
[例4]实验证明铜不能在低温下与氧气反应,铜不与稀硫酸反应,但工业上却在废铜屑与热的稀硫酸混合物中,通入空气制硫酸铜溶液。(1)写出上述反应的化学方程式 。(2)利用铜制备硫酸铜溶液还有什么方法?写出反应的化学方程式 。比较哪一种方法好?为什么?
[例5]将质量分数为p%的硫酸与等体积的水混合后得到质量分数为q%的硫酸。则下列关于p、q的关系式中正确的是
A.q<p<2q B.p<2q C.p=2q D.p≥2q
[例6](1)浓硫酸与木炭粉在加热条件下反应的化学方程式是: 。
(2)试用下图6-3所列各装置设计一个实验,来验证上述反应所产生的各种产物。
|
编号 |
① |
② |
③ |
④ |
|
装置 |
 |
 |
 |
 |
图6-3
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号): → →
→ 。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。
(4)装置②中所加固体药品是 ,可验证的产物是 ,确定装置②在整套装置中位置的理由是 。
(5)装置③中所盛溶液是 ,可验证的产物是 。
[例7]现有Na2SO3溶液和稀H2SO4两种溶液。
设计一个实验区别它们。所用试剂只有BaCl2溶液,仪器只有试管。试写出鉴别过程和结论。
第七章 总复习
(三)用途
1.利用其酸性可制磷肥、氮肥,可除锈,可制实用价值较大的硫酸盐等。
具体反应见“稀H2SO4”的性质。
2.利用其吸水性,在实验室浓H2SO4常用作干燥剂。
3.利用浓H2SO4的脱水性,浓H2SO4常作精炼石油的脱水剂、有机反应的脱水剂等。
4.利用浓H2SO4的高沸点难挥发性,常用于制取各种挥发性酸。
(二)浓硫酸
1.物理性质
纯硫酸是一种 色 状 体。常用的浓硫酸中H2SO4的质量分数为 ,若其密度为 1.84 g·cm-3,则其物质的量浓度为 mol·L-1。硫酸是一种高沸点 挥发的 酸, 于水,能以 比与水混溶。浓硫酸溶解时放出大量的热。
思考:(1)稀释浓硫酸应特别注意:① ;② 。浓硫酸与其他液体相互混合时也一定要注意上述两点。
|
NaCl(s)+H2SO4(浓)======NaHSO4+HCl↑,这是利用了浓硫酸的 ________性质。
2.特性
①吸水性
将一瓶浓硫酸敞口放置在空气中,其质量将 ,密度将 ,浓度 ,体积 。这是因为浓硫酸具有 性。利用这一性质在实验室里硫酸常用来 。
浓硫酸不仅可以吸收空气中的水,还可吸收混在气体中的水蒸气、混在固体中的湿存水、结晶水合物中的部分结晶水。
思考:(1)若将一瓶浓盐酸露置在空气中,可能会发生怎样的变化呢?
(2)不能用浓硫酸干燥的气体有 ,简述原因。
(3)实验室常用浓盐酸跟浓硫酸混合来快速简易制取HCl气体,请简述原因。
②脱水性
|

|
说明:有机物被浓H2SO4脱去水并不一定都生成碳。
思考:(1)将浓H2SO4滴到干燥的蓝色石蕊试纸上,可能发生什么现象?
③强氧化性
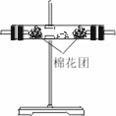
A.跟金属反应
a.常温下,浓硫酸能使 等金属钝化。
b.加热时,浓H2SO4可以与除金、铂之外的所有金属反应,生成高价金属硫酸盐,本身一般被还原成SO2。
|
|
 Cu+H2SO4(浓)
Cu+H2SO4(浓)
 Fe+H2SO4(浓)
Fe+H2SO4(浓)
在上述反应中,硫酸表现出了 。
思考: (1)金属与浓硫酸反应为什么不放出H2?
(2)在实验(6-5)中,浸有碱液棉花的作用是什么?
(3)2 mol浓硫酸跟足量金属铜反应能生成 1 mol SO2吗?
(4)浓硫酸的强氧化性源于+6价硫,在稀H2SO4中也有+6价硫,为什么稀H2SO4跟金属反应都放出H2?
B.跟非金属反应
热的浓H2SO4可将碳、硫、磷等非金属单质氧化到其高价态的氧化物或含氧酸,本身被还原为SO2,在这类反应中浓H2SO4只表现氧化性。写出上述三个化学方程式:
说明:(1)S被浓H2SO4氧化,只能变成+4价而不会变成+6价(为什么?)
(2)C、S、P等非金属单质被氧化成氧化物还是含氧酸,取决于含氧酸的稳定性。如H2CO3、H2SO3遇热均易分解,而H3PO4却很稳定。
思考:(1)把炽热的木炭投入热浓H2SO4中会放出气体,怎样检验生成了SO2和CO2气体?
(2)蔗糖与浓H2SO4的脱水实验中,为什么会闻到刺激性气味?
*C.跟其他还原性物质反应
浓H2SO4具有强氧化性,实验室制取H2S、HBr、HI等还原性气体,不能选用浓H2SO4。
|
|
2HI+H2SO4(浓)===== I2+SO2+2H2O
浓H2SO4还能跟其他还原剂发生反应,在今后将陆续学习。
(一)稀硫酸
稀硫酸是强电解质,具有酸的通性
H2SO4====2H++SO
完成下列反应,是离子反应的请改写成离子方程式。
Fe+H2SO4 →
CuO+H2SO4 →
Fe2O3+H2SO4 →
BaCl2+H2SO4→
Ba(OH)2+H2SO4 →
Na2CO3+H2SO4→
FeS+H2SO4→
Na2SO3+H2SO4→
NH3·H2O+H2SO4 →
Ca3(PO4)2+H2SO4 →
小结:酸的通性实质是H+的性质。
3.三氧化硫:一种无色固体;具有酸性氧化物的通性。
SO3+H2O-→
SO3+OH--→
思考:结合以上反应,对比+4价硫中的SO2、H2SO3、SO32-还原性的强弱。
[例1]把单质硫和强碱(如NaOH)溶液加热至沸,反应后,硫转化为S2-和SO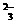 ,则反应的S和生成的S2-和SO
,则反应的S和生成的S2-和SO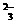 的物质的量之比为( )
的物质的量之比为( )
A.2∶1∶1 B.3∶2∶1 C.3∶1∶2 D.4∶1∶3
[例2]据下列四个反应:(1)H2S+I2====2H++2I-+S↓;(2)H2SO3+2H2S====3S↓+3H2O;(3)2I-+Br2====I2+2Br-;(4)H2SO3+I2+H2O====4H++2I-+SO ;确定Br-、I-、H2S、H2SO3的还原性由强到弱的顺序是( )
;确定Br-、I-、H2S、H2SO3的还原性由强到弱的顺序是( )
A.H2S>H2SO3>I->Br- B.Br->I->H2SO3>H2S
C.H2S>I->Br->H2SO3 D.I->Br->H2S>H2SO3
[例3]在标准状况下,750 mL含O3的O2,其中的O3若完全分解,其体积变为780 mL(标准状况),若将该含有O3的O2 1 L,通入适量的KI溶液中发生如下反应:2KI+O3+H2O====2KOH+I2+O2↑,则析出I2的质量为( )
A.0.68 g B.0.81 g C.0.91 g D.0.21 g
[例4]地球外层空间存在着少量的臭氧和氧原子,该臭氧层的存在能吸收和阻挡太阳光中有害的强烈的紫外线辐射,然而人为的大气污染物会破坏臭氧层,如超音速飞机排放物中氮的氧化物(NO和NO2),它们和O3及O发生如下反应:O3+NO====NO2+O2,O+NO2====NO+O2,这两个反应反复循环,总反应式为 。由此可见氮的氧化物在破坏臭氧层的过程中起了 作用。
[练习1]SO2和Cl2都具漂白作用,若将等物质的量的这两种气体,同时作用于潮湿的有色物质,此时可观察到有色物质
A.立刻褪色 B.慢慢褪色
C.先褪色后复原 D.颜色不褪
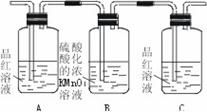
[练习2]检验SO2气体中是否混有CO2气体,可采用的方法是
A.通过品红溶液
B.通过澄清石灰水
C.先通过NaOH溶液,再通过澄清石灰水
D.先通过酸性KMnO4,再通过澄清石灰水
[练习3]在化合物X2Y和YZ2中,Y的质量分数分别约为40%和50%,则在化合物X2YZ3中,Y的质量分数约为
A.20% B.25% C.30% D.35%
[练习4]某次采集酸雨样品,每隔一段时间测定一次pH,得到数据如下:
|
时间 |
开始 |
8小时 |
16小时 |
24小时 |
32小时 |
40小时 |
48小时 |
|
pH |
5.0 |
4.8 |
4.5 |
4.3 |
4.2 |
4.0 |
4.0 |
简答:
(1)放置时,雨水样品pH变化的主要原因。
(2)pH变化的离子方程式。
[练习5]①在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变蓝色,这是因为 ,反应的离子方程式是 。
②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为 ,反应的离子方程式是 。
③对比①和②实验所得的结果,将I2、ClO-、SO42-按氧化性由强到弱顺序排列为 。
2.亚硫酸盐(SO32-):具有盐的通性;具有较强的还原性。
完成下列离子反应方程式:
SO32-+H+-→
SO32-+O2-→
1.亚硫酸:二元弱酸;不稳定易分解;具有酸的通性;有较弱的氧化性,有较强的还原性;有暂时漂白性。
完成下列反应:
H2SO3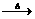
H2SO3+H2S-→
H2SO3+O2-→
H2SO3+Br2+H2O-→
H2SO3+NaOH-→
3.酸雨中的酸主要有硫酸和硝酸,酸雨的危害主要有 。导致酸雨形成的二氧化硫主要来源于三个方面:一是 ,二是 ,三是 。
亚硫酸、亚硫酸盐及三氧化硫
2.二氧化硫对大气的污染后果是形成酸雨。酸雨是指 ;正常雨水的pH约为 ,正常雨水也呈 性,这是因为
1.二氧化硫有毒,它对人体的直接危害是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com