
题目列表(包括答案和解析)
6、下列各组离子中,可大量共存的是: ( )
A、Cu2+、Cl―、S2― 、H+ B、SO42― 、Na+ 、OH―、 HSO3―
C、K+ 、Cl― 、NO3― 、Cu2+ D、K+ 、ClO― 、Cl― 、S2―
5、下列气体制取装置不相同的一组是: ( )
A、H2和CO2 B、CO2和SO2 C、NH3和O2 D、H2和H2S
4、NO2与H2O反应时,NO2: ( )
A、只作氧化剂 B、既是氧化剂,又是还原剂
C、只作还原剂 D、既不是氧化剂,又不是还原剂
3、下列保存物质的方法哪一种不对; ( )
A、少量白磷保存在水中 B、氢氟酸盛放在玻璃瓶中
C、金属钠保存在煤油中 D、氢氧化钠溶液、水玻璃盛放在带胶塞的玻瓶中
2、玻璃和水泥都要使用的原料: ( )
A、纯碱 B、石灰石 C、粘土 D、石英
1. 三个容器中分别装有H2、O2、N2,当温度和密度完全相同时,三种气体压强(P)的大小关系正确的是 ( )
A、 B、
B、 C、
C、 D、
D、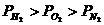
20、在0.15L某浓度的浓硫酸中加入铜片,加热使之反应,待铜片全部溶解后,冷却定容
为1.00L,取出0.05L稀释后的溶液,加入足量的铁粉,充分反应后,收集到1.68L(标准状况)气体。将残留固体经过过滤、洗涤、干燥、冷却后称量,质量减轻了3.96g。根据上述数据计算原硫酸溶液的物质的量浓度。
19、有一废水样品10L,经分析得知游离(Cl2)的浓度为0.012mol/L,废水中的H+浓度
为0.001mol/L。已知Cl2和Na2SO3在溶液中有如下反应:Cl2+Na2SO3+H2O=Na2SO4+2HCl
现欲除去其中的游离氯,并成为中性溶液,问:
(1)需加入浓度0.1mol/L的Na2SO3溶液多少升?(2)需加入固体烧碱多少克?
18、 业上测量SO2、N2、O2混合气体中SO2含量的
业上测量SO2、N2、O2混合气体中SO2含量的
装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写分子式)
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)
(3)反应管内的碘的淀粉溶液也可以用 代替(选填一种物质名称)
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为.
(填仪器编号)a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
17、同主族元素其性质相似。例如,硫化物性质类似于氧化物;它也可以分为酸性硫化物
和碱性硫化物;也存在氧化性或还原性;互相间也能发生反应。例如:Na2S+CS2===Na2CS3(硫代碳酸钠),完成下列反应方程式:
(1)Na2S+As2S5 →
(2)Na2S+SnS2 →
(3)Na2S2+SnS →
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com