
题目列表(包括答案和解析)
25.将由重水(D2O)和轻水(H2O)组成的水电解,在阴、阳两极共得到气体1.85克,气体的总体积在标准状况下为3.36升,求生成的H2和D2的物质的量比。
24.已知钠元素只有一种23Na,氯元素有两种同位素35Cl和37Cl,又知氯元素的平均原子量为35.5。计算11.7克食盐中,含23Na 35Cl和23Na37Cl各多少克?
23.同一周期中的X Y两种元素,它们以共价键相结合时生成气态物质XY2,将它们通入水中,所得溶液能使石蕊试液变红,另一种元素R,它的离子R2+与氩原子电子层结构相同;X Y R三种元素可生成一种化合物RXY3,该化合物在强热条件可分解生成气体XY2和固体RY,那么XY2的化学式是_____________,RY的化学式是_________,RXY3的化学式是______________。
22.HI的还原性比HBr、HCl、HF都强,主要是因为HI分子中,H-I键的键能大。( )
21.凡是ⅠA族和ⅦA元素的原子化合时,一定形成离子键。( )
20.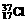 离子与
离子与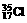 属于同位素。( )
属于同位素。( )
19.元素的原子都是由质子、中子和电子3种微粒构成的。 ( )
18.门捷列夫在19世纪中叶,曾根据他所发现的周期律预言过第四周期第ⅣA族的锗(当时称为类硅)元素的性质。通常同一族中由上而下元素性质是逐渐变化的,其中一个“未知”元素的物理性质大致在上下两种元素物理性质的中间。当时已知密度:Si是4.8 g/cm3;Sn是5.8 g/cm3;比热容:Sn是218 J·kg-1·K-1,Pb是130 J·kg-1K-1。试根据周期律推测:
(1)估计锗的物理性质:密度、比热容_____________。(2) 锗的金属性和非金属性,锗能否与酸碱作用?________________________。(3)Ge(OH)4的酸碱性?______________。(4)GeH4的稳定性?_____________。
17.带有2个单位正电荷的微粒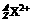 ,它的质量数A是137,中子数N是81,那么它的核电荷数Z是_________,核外电子数是___________。
,它的质量数A是137,中子数N是81,那么它的核电荷数Z是_________,核外电子数是___________。
16.α射线是由α粒子组成的,α粒子是一种没有核外电子的微粒,它带有2个单位的正电荷,它的质量数等于4,由此可推断,α粒子带有________个质子,__________个中子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com