
题目列表(包括答案和解析)
2.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的相对原子质量为192.22,这两种同位素的原子个数比应是( )
A.39∶61 B.61∶39 C.1∶1 D.39∶11
1.下列关于氧化物的叙述中,正确的是( )
A.酸性氧化物都可以跟强碱溶液反应
B.与水反应可生成酸的氧化物都是酸性氧化物
C.金属氧化物都是酸性氧化物
D.不能跟酸反应的氧化物一定能和碱反应
3.化学键的破坏
①化学反应过程中反应物中的化学键被破坏。如H2+F2====2HF,H-H、F-F键均被破坏。
②对离子化合物,其溶解于水后,便成为自由的阴、阳离子,离子键被破坏。其熔化后,也成为自由的阴、阳离子,离子键被破坏。
③对于共价化合物,有些共价化合物溶于水后,能与水作用,其分子内共价键被破坏。如HCl、HBr等。
④对于某些很活泼的非金属单质,溶于水后,能与水作用,其分子内共价键被破坏。如Cl2、F2等。
[例1]关于化学键的下列叙述中,正确的是
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中不含离子键
[例2]下列分子的电子式书写正确的是

[例3]下列各分子中所有原子都满足最外层为8电子结构的是
A.BeCl2 B.PCl3
C.PCl5 D.N2
练习1.下列物质中,含有共价键的化合物是( )
A.碘化氢 B.烧碱 C.液溴 D.食盐
练习2.下列说法正确的是( )
A.钠原子与氯气反应生成食盐后,其结构的稳定性增强。
B.阴、阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小。 C.失电子难的原子获得电子的能力一定强。
D.两个原子之间的相互作用叫化学键。
练习3.已知氢化锂(LiH)属于离子化合物,Li跟水反应可以放出H2,下列叙述中正确的是( ) A.LiH的水溶液显中性
B.LiH是一种强氧化剂
C.LiH中的氢离子可以被还原成H2
D.LiH中的氢离子与锂离子的核外电子排布相同
练习4.有A、B、C、D四种元素,A的正二价离子与氩原子的电子层结构相同,B原子有三个电子层,其单质为双原子分子,C的核外电子比A少一个,B与D同周期,其单质为淡黄色固体。
(1)写出A、B、C、D的离子符号。
(2)A、B、C、D的离子半径由小到大的顺序是怎样的?
(3)用电子式表示这四种元素中两两形成离子化合物的过程。
练习5.据报道,美国科学家卡尔·克星斯特于1998年11月合成了一种名为“N5”的物质。由于其极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形,如果5个N结合后都达到8电子结构,且含有2个N≡N叁键,则“N5”分子碎片所带电荷及其电子式如何?
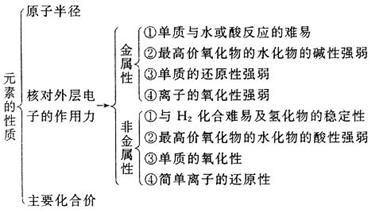
2.物质中的化学键的判断规律
①离子化合物中一定有离子键,可能还有共价键。简单离子组成的离子化合物中只有离子键,如MgO、NaCl等,复杂离子(原子团)组成的离子化合物中既有离子键,又有共价键,如(NH4)2SO4、NH4NO3、NaOH、Na2O2等。
②共价化合物中只有共价键,一定没有离子键,这是因为共价化合物中只有原子间共用电子对,没有带电荷的阴、阳离子。如HCl、CH4等。
③非金属单质中只有共价键。
④稀有气体由单原子组成,无化学键。
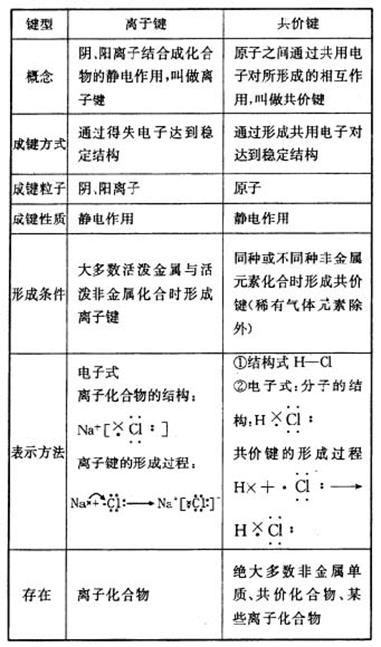
1.离子键与共价键的比较
[例1]镭是元素周期表中第七周期第ⅡA族元素。下列关于镭的性质描述不正确的是( ) A.在化合物中呈+2价 B.单质能使水分解,放出氢气
C.氢氧化物呈两性 D.碳酸盐难溶于水
[例2]下列关于元素化合价的叙述中,错误的是( )
A.ⅢA族的B和Al都能形成+3价的化合物
B.ⅣA族的C和Si都能形成+4价的化合物
C.ⅥA族的O和S都能形成+6价的化合物
D.ⅦA族的F和Cl都能形成+7价的化合物
[例3]20 g AO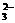 中核外电子数比质子数多0.5 NA个,则元素A的相对原子质量为( ) A.12 B.32 C.60 D.80
中核外电子数比质子数多0.5 NA个,则元素A的相对原子质量为( ) A.12 B.32 C.60 D.80
[例4]A7.A和B是同周期相邻的元素,和C是同主族相邻元素,已知三种元素的核电荷数之和为33,则A可能为( )
A.S B.O C.Si D.C
[例5]某元素X所形成的分子X2共有三种,其式量依次为158、160、162;其三种分子的物质的量之比是7∶10∶7,则下列结论正确的是( )
A.X有三种同位素
B.其中一种同位素的原子质量数为80
C.质量数为79的同位素其原子的百分含量为50%
D.X2的平均式量为159
[例6]有X、Y、Z三种元素,X元素最高正价是负价绝对值的3倍,X的气态氢化物与最高价氧化物式量之比为1∶2.35。X的原子核内质子数与中子数相等。Y与X能形成离子化合物Y2X,在Y2X中共有38个电子。Z原子与Y原子的电子层数相同,原子的最外层电子数Z=X+Y,试推断X、Y、Z各是什么元素。
[练习1]关于元素周期律和元素周期表的下列说法,正确的是
A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B.元素的性质随着原子序数的增加而呈周期性变化
C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献
D.同一主族的元素从上到下,金属性呈周期性变化
[练习2]下列叙述正确的是
A.同周期元素的原子半径以ⅦA族的为最大
B.在周期表中零族元素的单质全部是气体
C.ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
[练习3]已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中正确的是
A.铍的原子半径大于硼的原子半径
B.铍的金属性比锂强
C.氢氧化铍的碱性比氢氧化钙弱
D.单质铍跟冷水反应产生氢气
[练习4]某元素一种同位素原子的质子数为m,中子数为n,则下述论断正确的是
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若碳原子质量为W克;此原子的质量为(m+n)W克
D.核内中子的总质量小于质子的总质量
[练习5]X和Y属短周期元素,X原子的最外层是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为
A.XY B.XY2 C.XY3 D.X2Y3
[练习6]X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z是
A.Mg、Al、Si B.Li、Be、Mg
C.N、O、S D.P、S、O
[例1]X元素的阳离子和Y元素的阴离子具有与氩元素相同的电子层结构。下列叙述正确的是( )
A.X的核电荷数比Y的小
B.X的最高价氧化物一定是X2O,Y的气态氢化物为H2Y
C.X的离子半径比Y的大
D.X的最高正价比Y的小
[例2]有A、B、C三种元素。A元素的原子最外层电子数是2;B元素的原子最外层得到2个电子就达到稳定结构;C元素最外层电子数是次外层电子数的3倍。则这三种元素组成的化合物可能是( )
A.ABC3 B.ABC2 C.ABC4 D.A2BC3
[例3]元素X与氢气化合生成的化合物组成为XH3,其最高价氧化物中含氧元素的质量分数为74.07%,原子核内质子数和中子数相等,则下列说法正确的是( )
A.X元素的质子数为14
B.最高价氧化物对应水化物的化学式是H2XO4
C.X元素的非金属性比氯元素弱
D.X的氢化物XH3稳定性比H2O强
[例4]氧化性随原子序数的增加而增强的是( )
A.F-、Cl-、Br- B.Na+、Mg2+、Al3+
C.P、S、Cl D.Li+、Na+、K+
[例5]下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P
[例6]下列各组微粒半径(r)之比大于1的是( )
A. r(Cl) / r(F) B. r(I-)/r(I) C. r(Mg2+)/(Na+) D. r(F-)/r(Cl-)
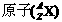

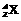 的意义:表示一个质量数为A、质子数为Z的原子。
的意义:表示一个质量数为A、质子数为Z的原子。
相互关系:
(1)质量关系
质量数(A)=质子数(Z)+中子数(N)
(2)电性关系:
原子:核电荷数=质子数=核外电子数
阴离子:质子数=核外电子数-电荷数
阳离子:质子数=核外电子数+电荷数
[例1]美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是
A.57 B.47 C.61 D.293
[例2]已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式中正确的是
A.a=b+m+n B.a=b-m+n
C.a=b+m-n D.a=b-m-n
[例3]核内中子数为N的R2+,质量数为A,则它的n g氧化物中所含质子的物质的量是
A.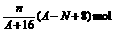 B.
B.
C.(A-N+2) mol D.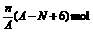
[例4]某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是 。
25.(8分)在标况下,将6.72L的CO2气体通过一定量的Na2O2气体通过一定量的Na2O2后,
收集到4.48L的气体;又将充分反应后的固体溶于水,得到200mL的溶液。请计算:
(1)4.48L气体的质量。
(2)最终溶液中Na+的物质的量浓度。
24.(6分)现在Na2CO3和NaCl固体混合物22.3g,完全溶于水后,加入足量的AgNO3溶液,
得到一定量的白色沉淀,用过量的称HNO3处理该白色沉淀,得到标况下的气体2.24L,
计算原混合物固体中NaCl的质量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com