
题目列表(包括答案和解析)
24、
(1)浓H2SO4与木炭粉在加热条件下反应的化学方程式:_____________________
____________________________________________________。
(2)试用图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置编号):
________→_________→__________→_________
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶中溶液不褪色。A瓶中溶液的作用是________________________,B瓶中溶液的作用是_____________________________
C瓶中溶液的作用是_____________________________。
(4)装置②中所加的固体药品是_________________,可确证的产物是______________。确定装置②在整套装置中的位置的理由是________________________________________
____________________________________________________________________________
(5)装置③中所盛液体是_______________可验证的产物是_______________________。
23、已知氮化钠(Na3N)在熔融时能导电,与H2O作用时有NH3产生同时还生成一种常见的强碱,试回答下列问题:
(1)氮化钠属于__________化合物(填“离子”或“共价”)用电子式表示Na3N与H2O反应产生的气体的形成过程:
________________________________________________________________________
(2)比较微粒半径:Na+______N3-(填“>”、“<”、“=”)
(3)Na3N与水反应的方程式________________________________________________
该反应属于_________ 反应。
 21、(8’)AB2型离子化合物的阴、阳离子的电子层结构相同,每摩AB2分子中含有54mol电子。已知还有下列反应:
21、(8’)AB2型离子化合物的阴、阳离子的电子层结构相同,每摩AB2分子中含有54mol电子。已知还有下列反应:
①H2+B2 C ②B2+X→Y+AB2+H2O ③Y+C→AB2+Z(Z有漂白作用)
a写出下列物质的化学式:
AB2__________,X____________,Y____________,Z______________。
b用电子式表示化合物,AB2的形成过程:_________________________________
c写出反应②的化学方程式:________________________________________。
|
|
B |
|
|
A |
X |
C |
|
|
D |
|
22、(9’)A、B、C、D4种元素均为主族元素,在周期
表中分别处于元素X的四周,(见右图),已知X元素的
最高价氧化物的化学式为X2O5,且这五种元素中有一种
元素的原子半径是它所处的哪一族中半径最小的。
(1)写出下列各元素的元素符号
A______B______C_______D_______X________
(2)C、D、X的最高价氧化物对应的水化物的酸性由弱到强的顺序为______________________________________________________
(3)A、B、X所形成的3种气态氧化物的稳定性由强到弱的顺序为:
________________________________________________________
(4)在周期表中排放在A前面且与A紧密相邻的元素的氧化物与NaOH溶液反应的离子方程式为:
_____________________________________________________________________________
20、
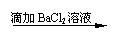 (8分)几位同学设计了下列实验方案以检验SO42-,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试溶液中含有SO42-。请你简要分析说明各方案是否严密。
(8分)几位同学设计了下列实验方案以检验SO42-,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试溶液中含有SO42-。请你简要分析说明各方案是否严密。
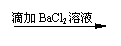
 方案甲: 试液
白色沉淀
未逸出气体,也未见沉淀溶液解
方案甲: 试液
白色沉淀
未逸出气体,也未见沉淀溶液解

 方案乙: 试液
无沉淀 、无气体
白色沉淀
方案乙: 试液
无沉淀 、无气体
白色沉淀
方案丙: 试液 无沉淀 白色沉淀
方案_________(填“甲、乙、丙”)严密,并说出上述方案严密或不严密的理由。
方案甲:______________________________________________________________
方案乙:______________________________________________________________
方案丙:______________________________________________________________
19、(4分)如图所示,弹簧测力计下悬挂一重
物(不与溶液反应),若向CuSO4溶液中逐渐滴
加Ba(OH)2溶液至恰好完全反应后,弹簧测力
计的示数将_________(填“变大”、“变小”或
“不变” );发生反应的离子方程式是:
________________________________________。
18、VCD光盘上的光记录材料有多种,其光记原理是:在激光照射下发生物理变化或化学变化,从而记录储存信号。碲的某种化合物是常见的一种VCD光记录材料,下列关于碲及其化合物的叙述不正确的是:
A、Te位于元素周期表的第四周期,VIA族
B、Te通常的氧化物有TeO2和TeO3
C、H2TeO4的酸性比H2SO4的酸性强
D、热稳定性H2Te比H2S弱





 高一化学期中试题答案页
高一化学期中试题答案页
第Ⅱ卷(非选择题48分)
17、臭氧可使湿润的淀粉KI试纸变蓝,反应的化学方程式为:
O3+KI+H2O→KOH+I2+O2(未配平)
下列结论不正确的是:
A、O3的氧化能力大于O2
B、反应中O3是氧化剂,KI是还原剂
C、反应中,1molO3得到2mol电子
D、反应中氧化产物I2与还原产物的O2的物质的量之比为1:1
16、已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中正确的是:
A、铍的金属性比钠强
B、BeCl2的氧化性比LiCl强
C、Be(OH)2 的碱性比Ca(OH)2的弱
D、单质铍易跟冷水反应产生H2
15、不能说明氧元素比硫元素非金属性强的事实是:
A、热稳定性H2O比H2S强
B、H2S的水溶液在空气中会变浑浊
C、H2O比H2S的沸点高
D、在一定条件下O2与Cu反应生成CuO,S与Cu反应生成Cu2S
14、A、B、C、D、E五种元素,从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下:
|
A |
B |
C |
D |
E |
五种元素不一定位于同一周期,则下列说法中正确的是:
A、E元素的最高化合价为+7时,D元素的负化合价可为-2价
B、A(OH)n为强碱时,B(OH)m也一定为强碱
C、HnDOm为强酸时,E的非金属性一定很强
D、HnCOm为强酸时,E的单质可能为强还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com