
题目列表(包括答案和解析)
28.(8分)用200g 36.5%的盐酸(过量)与17.4g MnO2反应,试回答下列问题:
(1) 理论上能产生标准状况下的氯气多少体积?
(2) 将反应后剩余的溶液过滤,再将滤液用水稀释至500ml,则稀释后的溶液Cl-的物质的量浓度是多少?
(3) 将稀释液取出100ml,加入足量的AgNO3溶液,可生成多少克白色沉淀?
27.(6分)在含有Na2CO3和Na2SO4的溶液里加入足量的BaCl2溶液,生成43.0g沉淀,把沉淀用足量的盐酸处理,可放出4.4 g CO2气休,则原溶液中所含Na2CO3和Na2SO4的质量分别是多少?(BaCO3:197 BaSO4:233 Na2CO3:106 Na2SO4:142)
26、(10分)实验室欲配制100mL 0.92mol/L的H2SO4溶液
(1)需要用到的仪器,除了烧杯、洗瓶(内盛蒸馏水)、空试剂瓶、玻璃棒、量筒,还必须有 ;
(2)若提供的是18.4mol/L的浓H2SO4,求所需量取的浓H2SO4的体积 mL;
(3)对配制过程中的下列说法,正确的是 。(填序号)
A.量筒量取浓硫酸后要冲洗并将冲洗液一起倒入小烧杯
B.量好体积的浓硫酸应先倒入小烧杯中然后再加水稀释
C.稀释好的稀硫酸要立即转移入容量瓶
D.若定容后摇匀液面又下降了,则不必再补加水至刻度线
(4)配制稀硫酸的容量瓶必须洗涤,若用刚配制过NaCl溶液的容量瓶未洗涤就配制稀硫酸,则所配稀硫酸浓度将 (偏高、偏低、不变);若用刚配制过NaOH溶液的容量瓶未洗涤就配制稀硫酸,则所配制的稀硫酸溶液的浓度将 (偏高、偏低、不变);若用刚配制过HCl溶液的容量瓶未洗涤就配制稀硫酸,则所配稀硫酸浓度将
(偏高、偏低、不变),氢离子浓度将 (偏高、偏低、不变)。
25.(7分)根据图①、图②回答下列问题:
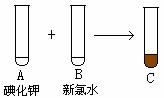
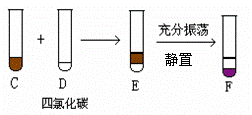
图① 图②
⑴A和B反应的化学方程式为 。
⑵四氯化碳是_____色、比水_______的液体。
⑶F中下层液体的颜色为_____色,上层液体中溶质的主要成分为______________。
⑷分离F中的两种液体通常应在___ 中进行(填仪器名称)。
23.(8分)在标准状况下,有:①4.8g CH4 ; ②11.2L HCl;③2.408×1023个H2S气体分子;
④ 0.2mol NH3。对于这四种气体而言,请用序号比较下列各项的大小:
(1)物质的量由多到少的顺序为: ;
(2)质量由大到小的顺序为:_________________________________;
(3)体积由大到小的顺序为:_________________________________;
(4)密度由大到小的顺序为:_________________________________。
|

|
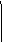
 B的水溶液
呈黄色
B的水溶液
呈黄色
|



 无色无味气体C
白色沉淀D
无色无味气体C
白色沉淀D
|
|

 E的水溶液 A的水溶液
E的水溶液 A的水溶液
⑴按以上的反应图式,写出它们的化学式
A ,B ,C ,D ,E 。
⑵写出①、②、③三个反应的离子方程式:
①_______________ ;
②___________________ ;
③____________________ 。
22.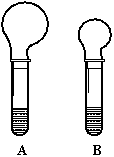 (8分)(1)右图是等质量的Na2CO3、
NaHCO3粉末分别与足量的盐酸发生反应时的情景,产生CO2气体的体积较少的试管中加入的固体试剂是_________,当反应结束时,A、B两试管中消耗盐酸的物质的量之比为________________。
(8分)(1)右图是等质量的Na2CO3、
NaHCO3粉末分别与足量的盐酸发生反应时的情景,产生CO2气体的体积较少的试管中加入的固体试剂是_________,当反应结束时,A、B两试管中消耗盐酸的物质的量之比为________________。
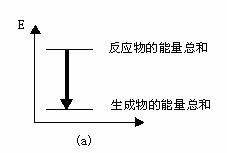
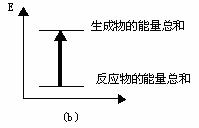
(2)实验过程中我们还能感受到Na2CO3与盐酸反应时是放
热反应,而NaHCO3与盐酸反应时表现为吸热。在A、B
两试管中,反应体系的能量变化的总趋势分别对应于
A-( ),B-( )。(在括号内填写a或b)
21. (5分)请用下列物质的序号填空:
A.Na2O2 B.Na2CO3 C.NaHCO3 D.K-Na合金
E.Na F.Ca(ClO)2 G.CaCO3 H.NaCl
(1)可用于潜艇中供氧剂的是 ;
(2)可用于消毒饮用水的是 ;
(3)可用作原子反应堆的导热剂的是 ;
(4) 可用作制取发酵粉或用于治疗胃酸过多的药物的是 ;
(5) 广泛用于玻璃、制皂、造纸、纺织工业上的是 。
20.在标准状况下,将VL气体A(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为
A.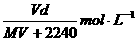
 B.
B.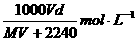
C.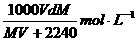 D.
D.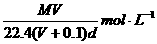
第Ⅱ卷(非选择题 共 60 分)
第Ⅰ卷答题栏
19.根据反应式:2Fe3++2I-=2Fe2++I2 , Br2+2Fe2+=2Fe3++2Br-,可判断离子的还原性从强到弱的顺序是:
A.Br-、Fe2+、Cl- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
18. 下列物质久置空气中,因发生氧化还原反应而变质的是
A、Na B、NaOH C、Na2O2 D、NaCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com