
题目列表(包括答案和解析)
20.用质量分数为ω的浓盐酸(其密度为ρ1 g﹒cm-3),按浓盐酸与水的体积比为1﹕3配制成稀盐酸(其密度为ρ2 g﹒cm-3),则所配制稀盐酸的物质的量浓度为
A.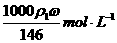 B.
B.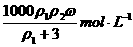
C.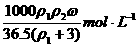 D.
D.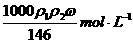
第Ⅱ卷(非选择题 共 60 分)
第Ⅰ卷答题栏
19.已知I-、Fe2+、SO2、Cl-和H2O2均具有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2。则下列反应不能发生的是
A.2Fe3+ +SO2+2H2O
== 2Fe2+ +SO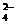 +4H+ B.I2 +SO2+2H2O
== H2SO4+2HI
+4H+ B.I2 +SO2+2H2O
== H2SO4+2HI
C.H2O2+H2SO4== SO2↑+O2↑+2H2O D.2Fe2+ +I2 ==2Fe3+ +2I-
18.在相同体积、相同物质的量浓度的一元酸溶液中,一定相等的是
A.溶质的质量 B.溶质的质量分数
C.溶质的物质的量 D.氢离子的物质的量浓度
17.在标准状况下,将V L气体A(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为
A.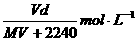
 B.
B.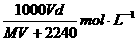
C.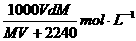 D.
D.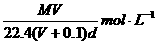
16.下列说法正确的是
A.某溶液中滴入AgNO3溶液,生成白色沉淀,该溶液中可能含Cl-
B.实验已经证明,氯水是可以导电的,所以氯水是电解质
C.某溶液与淀粉碘化钾溶液反应后出现蓝色,则证明该溶液是氯水或碘水
D.氟气跟氯化钠水溶液反应,有HF和O2生成
15.由CH4和O2组成的混合气体,在标准状况下的密度为1 g •L―1,则该混合气体中CH4和O2的体积比为
A.3:2 B.2:1 C.2:3 D.1:2
14.100mL1.5 mol•L―1H2SO4溶液与200mL1.0 mol•L―1NaOH溶液混合反应后,溶液中离子的物质的量浓度由大到小的顺序正确的是
A.c(Na+)>c(OH-)>c(SO42-)>c(H+) B.c(Na+)> c(SO42-)> c(H+)>c(OH-)
C.c(H+) > c(Na+)=c(OH-) >c(SO42-) D.c(SO42-)> c(Na+)> c(H+)>c(OH-)
13.能正确表示下列反应的离子方程式是
A. 钠跟水反应: 2Na+2H2O==2Na++2OH-+H2↑
B.氯气跟水反应:Cl2+H2O==2H++Cl-+ClO-
C.氢氧化钡和稀硫酸反应:Ba2++ SO42-==BaSO4 ↓
D.碳酸氢钠溶液中加入足量Ca(OH)2溶液:HCO3-+Ca2++OH-==CaCO3↓+H2O
12.下列物质的性质比较中,错误的是
A.稳定性HF>HCl>HBr>HI B.密度Cs<Rb<K<Na
C.还原性F->Cl->Br->I- D.离子半径Li+<Na+<K+<Rb+
11.设N0表示阿伏加德罗常数的数值,下列说法正确的是
A.11.2 L O2中含氧原子数为N0 B.18 g 水所含电子数为10N0
C.2.3 g 金属钠变为钠离子失去的电子数为N0
D.1 mol Na2O2与H2O充分反应转移电子数为N0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com