
题目列表(包括答案和解析)
8.下列关于氧气的叙述正确的是( )
A. 氧气可以用作燃料 B. 氧气可以使带火星的木条复燃
C. 红磷可以在氧气中自燃 D. 氧气能溶于水
7.近年来,许多城市都作出了限放烟花爆竹的规定,其原因主要是燃放烟花爆竹会( )
A. 污染水源 B. 产生温室效应 C. 污染土壤 D. 污染空气,产生噪音,引发火灾
6.打雷放电时,空气中有极少量的氧气会转化为臭氧(O3),即3O2放电==2O3。下列有关说法不正确的是( )
A. 该变化属于物理变化 B. O2和O3都是单质
C. O2和O3是不同的物质 D. 相同质量O2和O3的所含的分子的数目不相同
5.某无毒气体的密度约是空气密度的5/9,且极难溶于水,那么收集该气体所用的方法是( )
①向上排空气法;②向下排空气法;③排水法;
A. ①或② B. ①或③ C. ②或③ D. ①②③都可以
4.为了让灯泡通电发热时,消耗灯泡里的氧气,达到保护钨丝的目的,通常在白炽灯炮里的玻璃柱上涂有一层东西,该舞之势( )
A. 红磷 B. 氧化汞 C. 二氧化锰 D. 氯酸钾
3.为方便运输和使用,很多气体都用钢瓶储存,为了方便识别,不同气体的钢瓶被漆成不同的颜色。装有氧气的钢瓶会被漆成( )
A. 白色 B. 蓝色 C. 黑色 D. 黄色
2.火柴划着后,如果将火柴直立,使火焰在上,火柴就不易继续燃烧,其原因是( )
A. 氧气不足 B. 没有达到着火点 C. 火柴的着火点升高 D. 空气不足
1.采用燃烧的方法除去密闭容器中空气里的氧气,以测定空气中氧气的含量,选用下列那种物质最为适宜( )
A. 红磷 B. 硫磺 C. 木炭 D. 铁丝
3.掌握:氧气的实验室制法
① 反应原料:氯酸钾(KClO3,白色)和二氧化锰(MnO2,黑色),或高锰酸钾(KMnO4,紫红色固体)
② 反应条件:加热
③ 反应原理:2KClO3 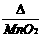 2KCl + O2↑;2KMnO4 加热== K2MnO4
+ MnO2+ O2↑
2KCl + O2↑;2KMnO4 加热== K2MnO4
+ MnO2+ O2↑
④ 发生装置:铁架台(带铁夹),酒精灯,试管,单孔塞,导管
⑤ 收集方法:向上排空气法(氧气的密度大于空气);排水集气法(氧气难溶于水)
⑥ 反应步骤:a. 按照要求安装反应仪器;
b. 检验反应装置的气密性;
c. 装入反应物质,注意,反应物质为粉末状的,应该用药匙或者纸槽;
d. 首先预热,然后对准固体下方固定加热;
e.如果用排水法收集,当导管均匀放出气泡的时候开始收集气体;
f. 用排水法收集时,反应结束应该首先将导管移出水面,然后熄灭酒精灯;
(否则会使水倒流至试管中,可能使试管破裂)
g. 待反应仪器冷却后,进行拆洗。
⑦ 注意事项:
a. 如果反应物品为高锰酸钾时,发生装置中导管口部还需要塞上少量棉花,避免高锰酸钾粉末堵塞导管;
b. 试管应略微向下倾斜(防止冷凝水回流,使试管底部破裂),导管应略微深入试管;
c. 如果用向上排空气法收集,注意要用磨口玻璃片,并且导管口应该尽量伸入集气瓶底部。
典型习题:
2.了解:空气的成分,氧气的性质及主要用途,氧气的工业制法
① 空气成分研究的科学家:舍勒和普利斯特里(制得了氧气),拉瓦锡(得出了空气的组成)
② 空气组成研究的反应:红磷在空气中燃烧 4P + 5O2 点燃== 2P2O5
③ 空气的成分:按体积分数,氮气78%,氧气21%,稀有气体0.94%,二氧化碳0.03%,其他杂质0.03%
注意:空气中各成分的主要性质及用途(如氮气、惰性气体)
④ 氧气的化学性质比较活泼,在高温条件下能与许多物质发生剧烈的化学反应。主要体现在较强的氧化性,及助燃性
a. 与金属发生反应
2Mg + O2 点燃== 2MgO(注意石棉网的使用)现象:发出耀眼的白光,生成一种白色的粉末状固体;
3Fe + 2O2 点燃== Fe3O4 (注意瓶底留有少量的沙或者水)现象:火星四射,生成一种黑色的固体;
2Cu + 2O2 加热== 2CuO (注意并不是点燃,不能燃烧)现象:红色的铜变成一种黑色的固体
2H2 + O2 点燃== 2H2O(淡蓝色火焰,在干冷烧杯内壁出现水珠)
b. 与非金属发生反应
C + O2 点燃== CO2 在空气中燃烧持续红热,在氧气中燃烧发出白光,生成一种能使澄清石灰水变浑浊的气体
S + O2 点燃== SO2 在空气中产生淡蓝色火焰,在氧气中产生明亮的蓝紫色火焰,生成一种刺激性气味的气体
4P + 5O2 点燃== 2P2O5 放出大量的白烟
c. 与化合物发生反应
2CO + O2 点燃== 2CO2 (蓝色的火焰);CH4 + 2 O2 点燃== 2H2O + CO2 (明亮的蓝色火焰)
C2H5OH + 3O2 点燃== 2CO2 + 3H2O ;2CH3OH + 3O2 点燃== 4H2O + 2CO2
⑤ 氧气的主要用途:支持燃烧,提供呼吸(气焊、气割、炼钢、液氧炸弹、呼吸等)
⑥ 氧气的工业制法:分离液态空气法。利用空气中氮气的沸点比氧气的沸点低,使氮气首先从液态空气中蒸发出来,留下的就是液态氧气。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com