
题目列表(包括答案和解析)
8.80年代,科学研制得一种新分子,它具有空心的类似足球状的结构,分子式为C60。下
列说法正确的是 ( )
A.C60是一种新型的化合物 B.C60含有离子键
C.C60和金刚石都是碳元素组成的单质 D.C60中的化学键只有共价键
7.M元素的一个原子失去2个电子,该2个电子转移到Y元素的2个原子中去,形成离子
化合物Z,下列说法中,正确的是 ( )
A.Z的熔点较低 B.Z可表示为M2Y
C.Z一定溶于水中 D.M形成+2价阳离子
6.下列过程中,共价键被破坏的是: ( )
A.碘晶体升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水
5.NaF、NaI、MgO均为离子化合物,现有下列数据,试判断这三种化合物的熔点高低顺序( )
|
物 质 |
① |
② |
③ |
|
离子电荷数 |
1 |
1 |
2 |
|
键长(10-10m) |
2.31 |
3.18 |
2.10 |
A.①>②>③ B.③>①>② C.③>②>① D.②>①>③
3.下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A.可溶于水 B.有较高的熔点 C.水溶液能导电 D.熔融状态能导电
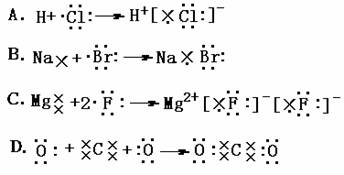 4.下列表示电子式的形成过程正确的是 ( )
4.下列表示电子式的形成过程正确的是 ( )
2.下列微粒中,既含有离子键又含有共价键的是 ( )
A.Ca(OH)2 B.H2O2 C.Na2O D.MgCl2
1.下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是 ( )
A.6和8 B.11和13 C.11和16 D.12和17
23.A、B、C、D、E五种元素的原子序数依次增大,且均小于18;A原子的最外层比B原
子的最外层少2个电子,A原子的最外层电子数是次外层电子数的两倍;A、B、C三种
元素能结合成化合物C2AB3,在1 mol C2AB3中共有52mol电子,D元素的单质0.5mol
与酸全部反应时,有9.03×1023个电子转移,在B与D形成的化合物,D的质量分数
为52.94%,D原子核内有14个中子,每个E原子与氢原子化合时只生成了一个共价单
键。试填写下列空白。
(1)这五种元素的名称
A B C D E
(2)A与B形成的高价化合物属于 分子(填“极性”、“非极性”)
(3)C在B中燃烧生成的化合物中化学键有 键和 键(填离
子、极性、非极性)
(4)A、B、C结合成的化合物的化学式是 。
22.A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次
递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比
K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。它们的元素符号分
别为:A ;B ;C ;B原子的结构示意
图为 ;BC2是由 键组成的 (填“极性”或“非
极性”)分子。
21.已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃常压即开始升华。
(1)氯化铝是 晶体(填“离子”或“分子”)。
(2)在500℃,1.01×105Pa时,氯化铝的蒸气密度(换算成标准状况)为11.92g·L-1,
且已知它的结构中还含有配位键,氯化铝的化学式为 。
(3)设计一个更可靠的实验,证明氯化铝是离子晶体还是分子晶体,你的实验是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com