
题目列表(包括答案和解析)
17、纯碱 苏打 白 固 Na2CO3·10H2O
CO+2H+==CO2↑+H2O 或 CO+H+==HCO
16、白 NaOH Na2O+H2O==2NaOH 碱 Na2CO3
1、D 2、B 3、D 4、D 5、B 6、C 7、C 8、A 9、B 10、C
23.(7分)一定质量的小苏打粉末经充分加热后,质量比原来减少了3.1g,剩余物的质量为
Ag;相同质量的小苏打和一定质量的结晶苏打((Na2CO3·xH2O)的混合物,经充分加热
后,质量比原来减少了10.3g,剩余物质的质量为Bg;又知B∶A=2∶1。试求:
(1)原小苏打和结晶苏打的质量;
(2)结晶苏打化学式中x的值。
22.(4分)有Na2CO3、NaHCO3、NaCl的固体混合物4g,现将其加热到质量不再减少为止,
冷却后称其质量为3.38g。在残存固体中加入过量盐酸产生CO20.88g,试求:
(1)原混合物中NaHCO3的质量。
(2)原混合物中NaCl的质量。
21.(6分)在一密闭容器中放有11.5gNA.4.4gCO2、5.4g水蒸气,此时压强为1.01×105Pa。
放置一段时间,保持温度不变,让几种物质充分反应。
(1)瓶中可能发生的反应方程式为_________________________________________。
(2)反应后容器中物质的总质量为_____________克。
(3)反应后残留固体成分及各成分的质量分别为_______________。
20.(8分)(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①Na2O2___________________________ ②Na2O________________________。
(2)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应
的化学方程式:______________________________________________。
(3)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反
应,请完成该反应的离子方程式:□O2-+□H2O--□H2O2+□O2+ □
19.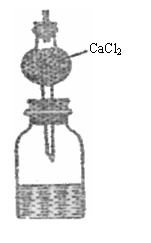 (8分)测定某种碱金属的相对原子质量设计的装置如图所示。该装置的总质量(包括水)
(8分)测定某种碱金属的相对原子质量设计的装置如图所示。该装置的总质量(包括水)
为ag,将质量为bg的碱金属投入水中,立即塞紧瓶塞
(水过量),完全反应后再称此装置的总质量为cg。则:
(1)列出计算该碱金属相对原子质量的数学表达式
_ _______________。
(2)无水CaCl2的作用是_________________________。
(3)如不用无水CaCl2,求出的相对原子质量比实际相对
原子质量_____ ___(填“偏大”、“偏小”),
理由是________________________________________。
18.(6分)钠与氢气在加热条件下反应生成氢化钠(NaH),NaH在熔融状态下能导电。取
少量氢化钠溶于水能剧烈反应,生成碱性溶液和一种可燃性气体。
写出钠与氢气反应的化学方程式________________________________________。
写出NaH与H2O的反应的化学方程式________________________________________,
反应中NaH作为________剂。
17.(6分)碳酸钠俗名________或________,是一种________色________体,含10个结晶
水的碳酸钠的化学式________________,写出碳酸钠与盐酸反应的离子方程式______
__________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com