
题目列表(包括答案和解析)
2.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,11.2L氯气所含有的原子数目为NA
B.9g水所含有的电子数目为0.5NA
C.1mol氯分子被还原成氯离子时得到的电子数目为NA
D.0.1mol甲烷含有的质子数目为NA
1.下列说法中正确的是
A.摩尔是表示物质质量的单位
B.10g氟化氢含有0.5molHF分子
C.2g氢气的体积约是22.4L
D.物质的摩尔质量等于其式量
28.(8分)将36mlKBr和KI的混合溶液分为二等份。向其中一份通如足量Cl2,完全反应后蒸发溶液至干,灼烧所得物质,得到6.1g固体残留物。测得另一份混合溶液中
I -的浓度为0.86mol/L。计算:
(1)固体残留物中含有什么物质?
(2)原溶液中含有KBr的质量是多少?
(3)反应完全时消耗Cl2的体积(标准状况)是多少?
27.(4分)配制250mL0.2mol/L的盐酸,需密度为1.19g/cm3,溶质质量分数为37.5%的浓盐酸多少毫升?
26.(9分)请利用下列装置及试剂组装一套装置。其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答:
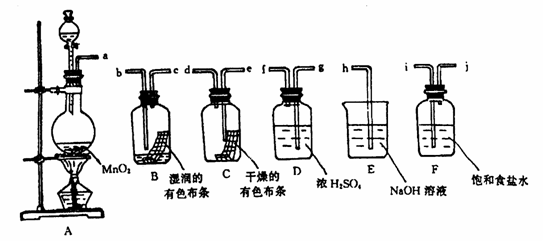
(1)按气体从左向右流向将各装置依次连接起来(填接口标号): a 接 ,
接 , 接 , 接 , 接 。
(2)烧瓶中发生反应的化学方程式是 。
(3)D装置的作用是 ,E装置的作用是 ,
F装置的作用是 。
(4)C瓶中的现象是 ,B瓶中的现象是 。以上事
实说明起漂白作用的物质是 。
25.(7分)实验室用2.0 mol/L NaCl溶液配制100mL 0.50 mol/L NaCl溶液。
(1)配制上述溶液,需要2.0 mol/L NaCl溶液 mL。
(2)配制上述溶液除需要玻璃棒、胶头滴管外,还需要的仪器有 、 、 。
(3)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不变”)
①没有洗涤烧杯和玻璃棒。 。
②定容时俯视容量瓶的刻度线。 。
③如果加水超过了刻度线,取出水使液面恰好到刻度线。 。
24.(5分)用“双线桥法”分析下列氧化还原反应电子转移情况,并指出氧化剂、还原剂、氧化产物、还原产物。
MnO2+4HCl(浓)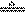 MnCl2+Cl2↑+4H2O
MnCl2+Cl2↑+4H2O
氧化剂 ,还原剂 ,氧化产物 ,还原产物 。
23.(6分)与16g氧气所含的分子数相同的氨气是 g;与16g氧气所含的原子总数相同的氨气是 g;相同条件下,在5.6g氮气中添加 g氨气,所组成的混合气体的体积与16g氧气所占的体积相等。
22.(2分)4.6g Na放在 g水中,才能使每10个水分子中溶有一个Na+。
21.(9分)新制的氯水显 色,说明氯水中有 分子存在。向氯水中滴入几滴AgNO3溶液,立即有 生成,说明氯水中有 存在。蓝色石蕊试纸遇到氯水后,首先变红,但很快又褪色,这是因为 。氯水经光照后,黄绿色消失,并放出无色的 气,该反应的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com