
题目列表(包括答案和解析)
23. 2mol·L-1; 2mol·L-1; 0.1mol·L-1; 0.4g; 100
1.B 2.C、D 3.A、B 4.D 5.B 6.C、D 7.B 8.A 9.D 10.C 11.D 12.B 13.B 14.A 15.C 16.B 17.A 18.C 19.D 20.B 21.B 22.D
30.A、B两种金属元素的原子量之比是8:9,将两种金属单质按物质的量之比为3:2组成混合物1.26g,跟足量稀硫酸溶液反应,放出氢1.344L(标准状况),这两种金属单质在反应中生成的氢气的体积相等。求A和B两种金属的摩尔质量。
答案与提示:
29. 在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1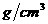 )中,所得盐酸的密度为1.18 g·cm-3。求:
)中,所得盐酸的密度为1.18 g·cm-3。求:
(1)该盐酸的质量分数。
(2)取这种盐酸10mL,稀释到1.45L,所得的稀盐酸的物质的量浓度。
28.实验室配制500mL0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体________g。
(2)配制时应选用________mL的容量瓶。
(3)若实验时遇到下列情况,将使溶液的浓度偏高、偏低或无影响。
A.加水定容时超过刻度线;________
B.忘记将洗涤液转入容量瓶;________
C.容量瓶洗涤后内壁有水珠而未作干燥处理;________
D.用托盘天平称量时,用生锈的砝码称量;_________
27.已知:Ca(ClO)2+4HCl(浓)=CaCl2+2H2O+2Cl2,若反应后产生氯气2.24L(标准状况),则消耗Ca(ClO)2的物质的量为 ,被氧化的Cl-为 mol,反应时电子转移的总数为 个。
26.36.5%的盐酸,密度是1.18g·cm-3,其物质的量浓度是__________;密度是1.84 g·cm-3、物质的量浓度为18.4mol·L-1的浓硫酸,其质量分数是______;将此浓硫酸10mL配成 2 mol·L-1的稀硫酸,则配成的稀硫酸的体积是______mL。
25.已知某饱和溶液:(1)溶液的质量ag(2)溶剂的质量bg(3)溶液的体积VL(4)溶质的摩尔质量M g/mol(5)溶质的溶解度Sg(6)溶液的密度r g/cm3。
试从上述数据中选择适当的数据,计算该饱和溶液的物质的量浓度c mol/L,将有关数式填入下表:
|
c= |
c= |
c= |
c= |
24.一定质量的某金属元素R的硝酸盐受热完全分解,反应按下式进行:
2RNO3 ==== 2R+2NO2+O2,结果得到21.6gR和6.72L气体(标准状况),R的相对原子质量是 。
23.用20gNaOH配成250mL溶液,它的物质的量浓度为 。取出5mL该溶液,它的物质的量浓度为 ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为 ,其中含NaOH的质量为 。该100mL溶液可以跟H+浓度为0.1mol/L的硫酸溶液 mL完全中和生成正盐。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com