
题目列表(包括答案和解析)
N=n·NA
满足上述关系的粒子是构成物质的基本粒子(如分子、原子、离子、质子、中子、电子数)或它们的特定组合.
如:1molCaCl2与阿伏加德罗常数相等的粒子是CaCl2粒子,其中Ca2+为1mol、Cl-为2mol,阴阳离子之和为3mol或原子数为3mol.
在使用摩尔表示物质的量时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称。例如说“1mol氧”,是指1mol氧原子,还是指1mol氧分子,含义就不明确。又如说“1mol碳原子”,是指1mol12C,还是指1mol13C,含义也不明确。
粒子集体中可以是原子、分子,也可以是离子、电子等。例如:1molF,0.5molCO2,1000molCO32-,amole-,1.5molNa2CO3·10H2O等。
1molF中约含6.02×1023个F原子;
0.5molCO2中约含0.5×6.02×1023个CO2分子;
1kmolCO32-中约含1000×6.02×1023个CO32-离子;
amole-中约含a×6.02×1023个e-;
以0.012kg12C所含的碳原子数作基准,其近似值为6.02×1023mol-1.
物质的量是国际单位制中七个基本物理量之一,1mol任何粒子都含有阿伏加德罗常数个粒子.1mol任何物质的质量在数值上等于该物质的相对分子质量。物质的量的单位是“摩尔”,“摩”符号为“mol”.
30.解:根据题意,A、B都是金属,物质的量之比为3:1,而产生的氢气相等,由此可知A与酸反应生成A2+,B与酸反应生成B3+
设A、B的相对原子质量为8M、9M,物质的量为3n、2n,共生成1.344L氢气,两种金属单质在反应中生成的氢气的体积相等,每种金属生成0.672L。
生成0.672L氢气的氢原子数与金属A提供的电子数相等,则:
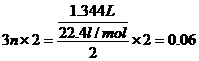 n = 0.01mol
n = 0.01mol
又据题意:3n×8M + 2n×9M = 1.26 M = 3
M(A)=3×8=24 M(B)=3×9=27
答:A和B两种金属的摩尔质量分别为24g·mol-1、27g·mol-1。
29.解:根据质量分数的概念:
(1)
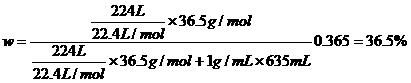
(2)稀释前后盐酸的物质的量相等,即:c1V1 = c2V2
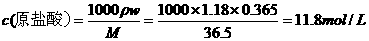
设稀释后的盐酸浓度为c,则:
10×11.8 = 1450×c
c = 0.08 mol·L-1
28.(1)14.3 (2)500
(3)偏低、偏低、无影响、偏高
27. 0.05 mol、 0.1、 6.02×1022
26. 11.8 mol·L-1、 98%、 92
25.
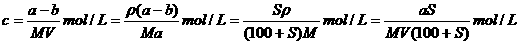
24. 108
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com