
题目列表(包括答案和解析)
0.1mol n(H2O)
n(H2O)=0.1mol
所以总共需H2O的质量为m(H2O)=(0.1mol+10mol)×18g·mol-1
=181.8g
例4 (1)标出Fe2O3与CO反应电子转移方向及数目.
(2)若此反应转移的电子数为a个,生成的CO2为bmol.
通过计算用ab表示阿伏加德罗常数为 .
解 (1) 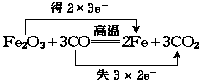
(2)由上述反应知,转移电子数为6e-时有3个CO2分子生成,电子转移数为a个时,N(CO2)= 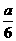 ×3=
×3=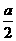
据公式:NA=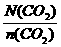 =
=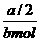 =
=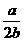 mol-1
mol-1
例5 在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR。则在此反应中Y和M的质量之比为( )
A.16∶9 B.23∶9 C.32∶9 D.46∶9
解:假设R与M的摩尔质量分别是为rg/mol和mg/mol,有r/m=22/9.又假设参加反应的Y为ag,生成M为bg。根据质量守恒定律可列出关系式:1.6+a=4.4+b,化简得a=b+2.8.
再根据方程式的比例式可得:8.8m=rb,b=3.6.
∴a/b=(b+2.8)b=(3.6+2.8)/3.6=16/9.答案为(A).
评析 “守恒法”解题是指在解题过程中利用化学反应或化学现象中的一些守恒关系来解决化学问题的一种独特的解题方法.本题依据质量守恒关系列式解题.只要“守恒法”使用得当,可收到解题步骤简捷、快速、准确之功效.
[典型热点考题]
例1 若1gN2中含有x个原子,则阿伏加德罗常数是( )
A.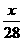 mol-1 B.
mol-1 B.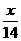 mol-1 C.14xmol-1 D.28xmol-1
mol-1 C.14xmol-1 D.28xmol-1
解析:求阿伏加德罗常数就是利用已知条件求1molN2中含有的原子个数NA(NA是未知数),应以物质的量为“桥梁”,用NA=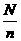 求得解决.
求得解决.
因为M(N2)=28g·mol-1,所以1gN2的物质的量为:n(N2)=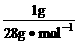 =
= mol
mol
n(N)=2n(N2)=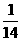 mol
mol
所以NA=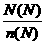 =
=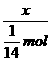 =14x·mol-1
=14x·mol-1
答案:选C.
例2 某固体仅由一种元素组成,其密度为5g/cm3.用X射线研究固体的结果表明:在棱长为1×10-7cm的立方体中含有20个原子,则此元素的相对原子质量最接近( )
A.32 B.65 C.120 D.150
解析:此题意在以“物质的量”作“桥梁”,借助“摩尔质量”来“引渡”,训练学生思维的灵活性.要求该元素的相对原子质量,亦即先求1mol该原子的质量,即是求出6.02×1023个该原子的质量.依题意,20个原子的质量
m=ρV=5g/cm3×(1×10-7cm)3=5×10-21g,故1mol该原子(约为6.02×1023个)的质量约为6.02×1023×5×10-21g/20=150g,所以该元素的摩尔质量为150g/mol,此元素的相对原子质量接近于150.
答案:D.
例3 下列数量的物质中含原子个数最多的是( )
A.0.4摩尔氧气 B.3.01×1022CO2分子
C.4℃时5.4毫升水 D.10g氖
解析:分别计算各物质中所含原子的物质的量,物质的量最大的即为原子个数最多的.A中n(0)=0.4×2=0.8mol,B中n=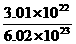 ×3=0.15mol,C中n=
×3=0.15mol,C中n=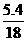 ×3=0.9mol,D中n=
×3=0.9mol,D中n=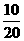 ×1=0.5mol,故选C.
×1=0.5mol,故选C.
答案:C.
例4 与24.5gKClO3所含O原子个数相同的KMnO4的质量应是( )
A.24.5g B.47.4g C.47g D.23.7g
解析:M(KClO3)=122.5g·mol-1
n(KClO3)=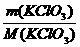 =
= mol=0.2mol
mol=0.2mol
n(O)=0.2×3mol=0.6mol
n(kMnO4)=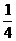 n(O)=
n(O)=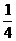 ×0.6mol=0.15mol
×0.6mol=0.15mol
m(kMnO4)=M(KMnO4)·n(KMnO4)=158×0.15g=23.7g
答案:D.
例5 在反应X+2Y = R+2S中,已知R和S的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR,在此反应中Y和S的质量之比为 .
解析:本题可巧妙地运用“质量守恒定律”求解.
由反应方程式:
X + 2Y =R + 2S
22 9×2
3.采用类比的方法,可以使概念通俗易懂,便于理解和记忆.
例1 下列说法正确的是( )
A.1mol氯含有6.02×1023个微粒 B.阿伏加德罗常数数值约等于6.02×1023
C.钠的摩尔质量等于它的相对原子质量 D.H2O的摩尔质量是18g
解析:A错误在于使用摩尔时没有指明微粒的名称,或为1mol氯气约含6.02×1023个氯气分子,或为1mol氯原子约含6.02×1023个氯原子.
B正确.
C错在把摩尔质量与相对原子质量混同,应为钠的摩尔质量在数值上等于它的相对原子质量.
D错在摩尔质量的单位,应为H2O的摩尔质量是18g/mol,故选B.
答案:B
例2 ①2gH2 ②2molNH3 ③9gH2O ④含1.505×1023个H2SO4分子的硫酸,所含原子数由少至多的顺序是
解析:比较所含原子数多少,只要计算出所含原子的物质的量进行比较即可.①2gH2含H原子为2mol,②2molNH3中原子为8mol,③9gH2O含原子为(9g/18g·mol-1)×3=1.5mol,④1.505×1023个H2SO4分子含原子为(1.505×1023/6.02×1023mol-1)×7=1.75mol,所以原子数由少至多顺序为:③④①②.
答案:③④①②
例3 根据反应:
Fe2O3+3CO 2F+3CO2,若有3mol电子转移,则有 mol铁生成,有 个CO分子参加反应.
2F+3CO2,若有3mol电子转移,则有 mol铁生成,有 个CO分子参加反应.
解析:本题意在以氧化还原反应为载体,考查学生灵活运用所学知识的能力.
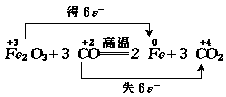
根据元素的价态变化不难看出,每生成1molFe得到了3mole-,每有1molCO参加反应失2mole-,故有3mole-转移时,有1molFe生成,消耗1.5molCO,N(CO)=n(CO)·NA=1.5mol×6.02×1023mol-1=9.03×1023
答案:1;9.03×1023
[难解巧解点拨]
例1 已知Ar(S)为32,则1个S原子的质量是 g.
分析 据Ar(S)=32,知1molS为32g,S原子数为6.02×1023个,故1个S原子的质量为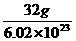 =5.32×10-23g.
=5.32×10-23g.
评析 若求每个离子的质量方法同上(因为得失电子产生的质量差可忽略)
例2 0.8g某物质含有3.01×1022个分子,该物质的相对分子的质量约为( )
A.8 B.16 C.64 D.160
解:据M=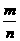 n=
n=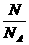 则M=
则M=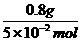 =16g·mol-1
=16g·mol-1
故选B
例3 2.3g金属钠与水反应所得溶液中,要使每100个水分子中溶有1个Na+离子.求所需水的质量.
解:100个水分子中溶有1个Na+即1molNa+对应水的物质的量应为100mol.2.3gNa为0.1mol,变成Na+其物质的量仍为0.1mol,溶液中应有水10mol包括反应消耗掉的水,即
2Na + 2H2O=2NaOH+H2↑
2 2
2.对于容易混淆的概念,如物质的量与摩尔,质量与摩尔质量,摩尔质量与相对分子质量、相对原子质量等,要通过对比,找出它们的区别与联系.
1.本节涉及的新概念很多,理论性强,也比较抽象,对概念的准确理解,过好概念关,是学习本节的关键.
2.物质的量与阿伏加德罗常数的区别和联系
|
物质的量 |
阿伏加德罗常数 |
|
|
区别 |
表示物质所含数目的集体的物理量、单位是摩尔 |
0.012kg12C所含碳原子数,单位mol-1 |
|
联系 |
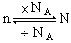 |
|
[重点难点解析]
1.物质的量与摩尔的区别和联系
|
|
物质的量 |
摩尔 |
|
区别 |
表示含有一定数目粒子的集体的物理量 |
为物质的量的单位 |
|
联系 |
摩尔是物质的量的单位 |
物质的量--n 物质的质量--m
摩尔质量--M 粒子数--N
阿伏加德罗常数--NA 相对原子质量--Ar
相对分子质量--Mr 质量分数--W
2.1mol粒子的质量以克为单位时在数值上都与该粒子的相对原子质量(Ar)或相对分子质量(Mr)相等.
1.定义:单位物质的量的物质所具有的质量叫摩尔质量,即1mol该物质所具有的质量与摩尔质量的数值等同.
1.5molNa2CO3·10H2O中约含1.5×6.02×1023个Na2CO3·10H2O,即约含有3×6.02×1023个Na+、1.5×6.02×1023个CO32-、15×6.02×1023个H2O.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com