
题目列表(包括答案和解析)
4.工业上制造金刚砂(SiC)的化学方程式如下:SiO2+3C====SiC+2CO↑,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )。
(A)1:2 (B)2:1
(C)1:1 (D)3:5
3.下列物质中,既不能导电,又不能溶解于水的是( )。
(A)硅藻土 (B)石墨
|
2.随着原子序数的递增,单质的熔沸点依次升高的族是( )。
(A)碱金属 (B)卤素
(C)碳族 (D)氮族
1.近年来出现了一些新的碳单质,如C60、C70等。C60、C70、金刚石、石墨都是碳元素的( )。
(A)同位素 (B)同素异形体
(C)同一元素 (D)同一物质
14. (1)赶走残留在广口瓶以及装置中的二氧化碳,使二氧化碳全部进入干燥管保证二氧化碳全部被吸收 (2)防止空气中的二氧化碳的干扰 (3)防止水蒸气进入干燥管导致结果误差
(4)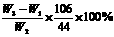 (5) 偏大 (6) 偏大
(5) 偏大 (6) 偏大
13. 2PbO·PbO2或Pb2(PbO4),化学方程式为:
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O Pb3O4+8HCl=3PbCl2+O2↑+4H2O
12. CeO2,CeO2+4HCl=CeCl4+2H2O CeO2+2NaOH=Na2CeO3+H2O
14.(6分)工业生产的纯碱常常含有少量NaCl等杂质。下图为测定纯碱纯度的方法之一。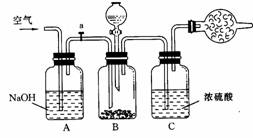
操作步骤是:
(1)检查气密性后,在干燥管中装入碱石灰,称 得重Wl g。
(2)称取一定量纯碱试样(W2g),放入B瓶。
(3)从分液漏斗中缓缓加入稀硫酸,直到不再产 生气体为止。
(4)打开开关d,缓缓鼓入空气5分后,再称得 干燥管总质量为W3 g。
回答下列问题:
(1)鼓入气体的目的是_________。
(2)装置A的作用是_________。
(3)装置C的作用是_________。
(4)纯碱的纯度计算式为_________。
(5)若去掉A,测定结果将_________ (填“偏大”、“偏小”、“无影响”)。
(6)若去掉C,测定结果将_________ (填“偏大”、“偏小”、“无影响”)。
第七章 硅和硅酸盐
第一节 碳族元素 (1课时)
13.(8分)Fe3O4可以写成FeO·Fe2O3,若看作一种盐时,又可写成Fe(FeO2)2。根据化合价规律和这种书写方法,若将Pb3O4用上述氧化物形式表示,其化学式可以写成_________;看成盐可以写成_________。等物质的量的Fe3O4和Pb3O4分别在一定条件下和浓盐酸反应时,所消耗HCl的物质的量相等;不同的是,高价铅能将盐酸氧化而放出氯气。写出Fe3O4、Pb3O4分别和浓盐酸反应的化学方程式:____________________________________。
12.(4分)锗元素的最高价氧化物的化学式是_________,它与盐酸反应的化学方程式是___________________________;氨氧化钠反应的化学方程式是___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com